Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
Siefert so spolupracovníkmi (Seifert H, Wisplinghoff H, Schnabel P, von Eiff C: Small Colony Variants of Staphylococcus aureus and pacemaker-related infection. Emerg Inf Dis., 9: 1315-1318, 2003) opísali prípad 63-ročného pacienta s implantovaným kardiostimulátorom, ktorý vyhľadal lekársku pomoc po tom, čo utrpel tupý náraz na miesto jeho inzercie s následnou dislokáciou kardiostimulátora, perforáciou kože a lokálnou infekciou. Kardiostimulátor bol odstránený, elektródy sa ponechali na mieste a pacientovi sa lokálne aplikoval gentamicín. Nový kardiostimulátor sa pacientovi implantoval na opačnej strane.
Štvrtý týždeň po zákroku bol pacient hospitalizovaný pre vzostup teploty na 39,7 °C a podkožný absces. Nasledovala chirurgická drenáž a intravenózna terapia cefuroximom. Z odobratého hnisu bol vykultivovaný kmeň S. aureus citlivý na oxacilín. O dva týždne po ukončení terapie sa u pacienta objavila zimnica a opätovný vzostup teploty. Empiricky sa mu podala kombinácia meropenemu s vankomycínom a odobral sa materiál na mikrobiologické vyšetrenie. Všetky vzorky boli kultivačne negatívne. Pretože pacientov klinický stav sa nezlepšoval, na ďalší týždeň sa mu odstránil nový kardiostimulátor, ale špičky elektród boli ponechané v myokarde. Antibiotická terapia sa zmenila na kombináciu vankomycínu s rifampicínom, ktorá sa pacientovi podávala 6 týždňov s dobrou klinickou odpoveďou. Po ukončení terapie však nastal opätovný vzostup teploty. Pacientove hemokultúry boli stále negatívne. Znova sa mu začal podávať vankomycín a jeho stav sa zlepšil. K vankomycínu sa pridal rifampicín a táto terapia pokračovala 10 týždňov. O týždeň po jej ukončení pacientovi opäť stúpla teplota a z hemokultúry sa vykultivoval kmeň, ktorý bol na základe morfológie, rastových a biochemických vlastností identifikovaný ako koaguláza-negatívny stafylokok, citlivý voči oxacilínu a vankomycínu a rezistentný voči rifampicínu. Molekulárno-biologická analýza izolovaného kmeňa však zistila prítomnosť génov pre termonukleázu a koagulázu, ktoré sú špecifické pre druh S. aureus a identifikácia sa uzatvorila ako S. aureus, fenotypová forma tvoriaca drobné kolónie (SCV; small colony variant) s auxotrofiou na hemín. Pacientovi sa začal podávať flukloxacilín (protistafylokokový penicilín) a jeho stav sa opäť zlepšil. V terapii sa pokračovalo ďalších 6 týždňov. O týždeň po ukončení tejto terapie nastal ďalší vzostup teploty a z hemokultúry sa opäť vykultivovala SCV forma S. aureus citlivá na oxacilín. Pacietovi sa začal znova podávať flukloxacilín a pri kardiopulmonálnom bypase sa mu odstránili špičky elektród z myokardu. Zo špičiek elektród sa izoloval kmeň s rovnakým biochemickým profilom aký mal SCV S. aureus z hemokultúry. Až tento posledný zákrok viedol k trvalému zlepšeniu a pacient bol prepustený z nemocnice.
Otázky ku kazuistike:
- Prečo dochádzalo u pacienta k opakovaným relapsom aj po cielenej antibiotickej terapii?
- Ktoré faktory mohli viesť ku vzniku SCV formy S. aureus v organizme pacienta?
- Prečo prišlo k trvalému zlepšeniu pacientovho zdravotného stavu až po vyňatí špičiek elektród?
V ložisku infekcie nastala fenotypová adaptácia infikujúceho kmeňa S. aureus – kultivačne sa v neskorších fázach infekcie izolovali SCV formy baktérií, ktoré boli pravdepodobne asociované s biofilmom na povrchu implantovaných elektród kardiostimulátora. Tieto formy prežili pôsobenie antibiotík počas terapie a po jej ukončení sa začali množiť a vyvolávali nové relapsy.
Prítomnosť cudzieho telesa a vznik biofilmu; terapia gentamicínom, ktorý selektuje SCV formy baktérií.
Odstránilo sa ložisko, v ktorom boli baktérie chránené pred pôsobením antibiotickej liečby biofilmovou formou rastu a fenotypovou adaptáciou (SCV formy) a z ktorého nastávali opakované reaktivácie infekcie.
Autor: Liškova A.1, Slobodníková L.2
Pracovisko:1Oddelenie klinickej mikrobiológie Fakultnej nemocnice v Nitre, 2Mikrobiologický ústav LF UK a UNB
Kazuistika
Muž vo veku 67 rokov, ktorý dovtedy nebol vážnejšie chorý, bol odoslaný lekárom prvého kontaktu na infekčnú kliniku spádovej nemocnice. Doplnením anamnézy bolo zistené, že pacient dva dni kašľal a bol febrilný (až 40,0 °C). Pri prijatí bola pozorovaná kľudová dušnosť, cyanóza pier, známky dehydratácie. Saturácia na periférii zmeraná pulzným oxymetrom bola 94 percent. Posluchový nález na pľúcach svedčil pre pravostrannú pneumóniu. Na snímke pľúc bola preukázaná obojstranná bronchopneumónia. Pacientovi už na príjmovej ambulancii boli aplikované parenterálne kryštaloidy a antibiotiká (ciprofloxacín a cefotaxim). Napriek tomu došlo k rýchlemu zhoršeniu stavu. V priebehu 2 hodín poklesla saturácia na 70 % a pacient bol preložený na jednotku intenzívnej starostlivosti. Tu sa začala neinvazívna oxygenoterapia. O ďalších 10 hodín prišlo náhle k zástave srdca, pacient bol kardiopulmonálne resuscitovaný a začala sa umelá pľúcna ventilácia. Na snímke pľúc o 24 hodín bola viditeľná výrazná progresia zápalových zmien. Na počítačovej tomografii (CT) pľúc bola preukázaná deštrukcia pľúcneho tkaniva s pleuroplastickými zmenami a na CT mozgu boli výrazné hypoxické zmeny. Laboratórne parametre už pri prvom vyšetrení svedčili pre bakteriálnu infekciu (C reaktívny proteín 417 mg/l, leukocyty 0,9 × 109/l) a začínajúce renálne zlyhanie (kreatinín 167 μmol/l). Z hemokultúry bol izolovaný Streptococcus pneumoniae sérotyp 3, citlivý na penicilín. Počas hospitalizácie, ktorá trvala 43 dní, neprišlo k obnove normálneho stavu vedomia a pacient exitoval.
Otázky ku kazuistike:
- Je typická lobárna pneumónia pre agens, ktorý spôsobil systémovú infekciu?
- Prečo sa stav pacienta napriek antibiotickej terapii nezlepšoval?
- Bola antibiotická terapia zvolená empiricky správna?
- Je infekcia pneumokokom preventabilná očkovaním aj u pacientov vyššieho veku?
- Je Streptococcus pneumoniae sérotyp 3 súčasťou vakcíny?
Streptococcus pneumoniae je typickým agensom, ktorý spôsobuje pneumóniu s náhlym začiatkom. Najčastejšie ide o lobárnu pneumóniu. Prežitie pacienta závisí od rýchlosti nasadenia adekvátnej antibiotickej terapie.
Aj v súčasnosti zostáva letalita pneumokokovej pneumónie u hospitalizovaných pacientov vysoká, je udávaná v rozmedzí 6 až 16 %, ale u pacientov vyžadujúcich intenzívnu starostlivosť až nad 20%. Pneumónia sa radí medzi invazívne pneumokokové ochorenia, pokiaľ je v priebehu ochorenia dokázaný Streptococcus pneumoniae v hemokultúre. 67-ročný pacient bol prijatý v štádiu plne rozvinutej septickej pneumónie s príznakmi počiatočného zlyhávania obličiek.
Cefalosporín tretej generácie je liekom voľby pri empirickom výbere antibiotickej terapie. Empiricky podaný ciprofloxacín v kombinácii s cefalosporínom by mohol pokryť pôvodcov atypických pneumónií, ktoré však neboli u pacienta dokázané.
Pneumokokové infekcie u starších pacientov sú preventabilné očkovaním.
Dostupné pneumokokové vakcíny obsahujú puzdrové antigény S. pneumoniae sérotypu 3, ktorý spôsobil pacientovi infekciu.
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
Matka priviedla k detskému lekárovi 5-ročné dievčatko s horúčkou a bolesťami hrdla, ktoré sa stupňovali pri prehĺtaní. Dievčatko bolo zachrípnuté, pri návšteve lekára malo teplotu 38,5 °C, erytematóznu faryngeálnu sliznicu, zväčšené tonzily s bielym povlakom a zväčšené, bolestivé cervikálne lymfatické uzliny. Kašeľ ani nádcha neboli prítomné.
Otázky ku kazuistike:
- Ktoré mikroorganizmy môžu vyvolávať tonzilofaryngitídy detí?
- Ktorý mikroorganizmus bude najpravdepodobnejším pôvodcom infekcie na základe veku pacientky a klinických príznakov?
- Aké testy sa môžu použiť v ambulancii lekára na odlíšenie pôvodcu infekcie?
- Aký materiál na mikrobiologické vyšetrenie sa odoberá pri klinických príznakoch opísaných u dieťaťa a ako sa odosiela do laboratória?
- Aká je terapia, ak je pôvodcom Streptococcus pyogenes?
- Aké sú možné príčiny zlyhania penicilínovej liečby angíny vyvolanej S. pyogenes?
- Čo môže byť príčinou opakovaných streptokokových tonzilitíd?
- Čo je najčastejším dôvodom opakovaných reinfekcií baktériou S. pyogenes?
- Aké môžu byť následky neliečenej streptokokovaj tonzilitídy?
- Je k dispozícii vakcína na prevenciu streptokokových angín?
(Prípad je modelový)
Najčastejšie sú to respiračné vírusy, z baktérií Streptococcus pyogenes, zriedkavo aj iné baktérie (napr. Arcanobacterium haemolyticum)
Streptococcus pyogenes
CRP, rýchly dôkaz antigénu S. pyogenes (skupinový antigén „A“) imunochemickými metódami (napr. latexová aglutinácia, imunochromatografia).
Výter tonzíl, ktorý sa zasiela v skúmavke s transportným médiom.
Perorálny penicilín-V a podporná terapia – teplo, pokoj na lôžku, tekutiny a pestrá strava; vzhľadom na podávanie antibiotík sú vhodné aj vitamíny a probiotiká. Pri alergii na penicilín sa podávajú makrolidové antibiotiká, je však potrebné overiť citlivosť izolovaného kmeňa.
Všetky kmene S. pyogenes sú zatiaľ citlivé na penicilín, príčinou môže preto byť zlá kompliance (dodržiavanie liečebého režimu – v tomto prípade užívanie antibiotík) alebo prítomnosť ďalších baktérií na sliznici dýchacích ciest, ktoré tvoria betalaktamázy.
Rast baktérií v biofilme, alebo ich intracelulárna perzistencia môžu byť príčinou reaktivácie baktérií po antibiotickej terapii. Možné sú aj opakované reinfekcie.
Antigénová variabilita M-proteínu, ktorý je protektívnym antigénom tejto baktérie.
Peritonzilárny alebo retrofaryngeálny absces, iné infekcie hlavy a krku, v závažných prípadoch aj sepsa. K postreptokokovýcm imunopatologickým následkom patrí reumatická horúčka, akútna glomerulonefritída a chorea minor.
Nie, pretože M-proteín, ako aj ďalšie antigény S. pyogenes môžu vyvolať tvorbu krížovo-reagujúcich protilátok a vznik imunopatologických následkov.
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
55-ročnú pacientku hospitalizovali na kožnej klinike pre rozsiahly erytém a opuch okolo miesta poštípania hmyzom na ramene. Pacientka bola afebrilná, bez ďalších patologických nálezov. Prvotná klinická diagnóza bola alergická reakcia na poštípanie hmyzom. Na druhý deň hospitalizácie sa u pacientky objavila horúčka, tachykardia a začala stúpať hladina CRP. Pacientke sa odobrala hemokultúra a kožný ster z miesta poštípania a empiricky sa jej podal intravenózne klindamycín. Pacientkin stav sa však naďalej zhoršoval, zintenzívnili sa príznaky sepsy a nastúpila silná bolesť postihnutého ramena. Z hemokultúry sa vykultivoval Streptococcus pyogenes, rezistentný voči klindamycínu. Na základe výsledkov mikrobiologického vyšetrenia sa zmenila antibiotická liečba – pacientke sa začal podávať intravenózne penicilín – a urobila sa chirurgická revízia postihnutej oblasti. Po otvorení lézie sa zistila prítomnosť nekrotizujúcej fasciitídy. Urobil sa rozsiahly debridement (odstránenie nekrotického tkaniva) a vzhľadom na veľmi závažný klinický stav pacientky sa k terapii pridal linezolid. Po dvojtýždňovej intenzívnej terapii sa pacientkin stav zlepšil a bola preložená na kliniku plastickej chirurgie na upravenie stavu, ktorý vznikol odstránením nekrotického tkaniva na ramene.
Otázky ku kazuistike:
- Čo bolo zdrojom infekcie a bránou vstupu?
- Ktoré faktory viruelncie pôvodcu boli zodpovedné za vznik takejto závažnej invazívnej infekcie?
- Prečo sa okrem penicilínu pridal k liečbe aj linezolid?
- Aké sú možnosti prevencie takýchto infekcií?
(Skutočný prípad, upravené; podľa archívnych záznamov MIU a kliník UNB)
Pravdepodobne to bola kolonizácia pacientkinej kože kmeňom S. pyogenes, ktorý prenikol do drobnej ranky po bodnutí hmyzom a vzhľadom na veľmi nízku infekčnú dávku vyvolal infekciu. Do úvahy prichádza aj kontakt miesta poštípania s kolonizovanými alebo infikovanými osobami (vnúčatá, manžel), alebo s kontaminovanými predmetmi (napr. vankúš, uterák a pod.)
Tvorba vysokých koncentrácií toxínov – proteáz, cytolyzínov, hyaluronidázy, fibrinolyzínu, DN-ázy a pravdepodobne aj pyrogénneho exotoxínu (superantigén).
Pri liečbe invazívnych infekcií mäkkého tkaniva vyvolaných S. pyogenes sa odporúča podávať kombináciu penicilínu s antibiotikami inhibujúcimi proteosyntézu, ktoré znížia množstvo toxínov vyprodukovaných baktériou, čím sa zníži virulentnosť baktérie, obmedzí sa jej ďalšie šírenie a poškodenie tkaniva. Vzhľadom na rezistenciu pacientkinho kmeňa voči klindamicínu a vzhľadom na kritický stav pacientky sa podalo alternatívne zásobné antibiotikum – linezolid.
Osobná hygiena a správne ošetrenie každej kožnej lézie, vrátane ranky po poštípaní hmyzom.
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
De Freitas Silva so spolupracovníkmi (De Freitas Silva, E.C., Montalvão, C.R., Bonafé, S.: Infectious endocarditis from Enterococcu faecalis associated with tubular adenoma of the sigmoid colon. Hindawi Case Reports in Infectious Diseases, vol. 2017, Article ID 3095031. 4pp. https://doi.org/10.1 155/2017/3095031) opísali prípad 55-ročného muža s prolapsom mitrálnej chlopne, miernou aortálnou insuficienciou a mitrálnou regurgitáciou, ktorý vyhľadal lekársku pomoc pre dva týždne trvajúcu teplotu s nočným potením, myalgiou a anorexiou. Laboratórne testy ukázali miernu leukocytózu, zvýšenú sedimentáciu a CRP. V moči sa zistila pyúria a pri kultivačnom vyšetrení moču Escherichia coli v signifikantnom počte. Pacientovi sa odobrali aj tri sady hemokultúr a napriek neprítomným klinickým príznakom močovej infekcie sa začala terapia gentamicínom na základe výsledkov kultivácie moču. Pacientov stav sa však nezlepšoval ani pri tejto terapii a na desiaty deň po úvodnom vyšetrení sa u neho objavili Janewayove lézie a nový diastolický aortálny a systolický šelest. Transezofageálna echokardiografia odhalila vegetáciu s veľkosťou 5 mm na anteriornej časti mitrálnej chlopne. V tomto období už boli známe aj výsledky hemokultivácie. Vo všetkých troch hemokultúrach rástol kmeň Enterococcus faecalis citlivý na ampicilín a testy citlivosti vylúčili vysokú hladinu rezistencie na gentamicín. Pacientovi sa začala podávať účinná antibiotická terapia a jeho stav sa postupne upravil.
Vzhľadom na opísané zdravotné ťažkosti pacienta, vek a rodinnú anamnézu, sa po upravení jeho klinického stavu podrobil kolonoskopickému vyšetreniu, pri ktorom sa mu odstránil polypózny útvar. Na základe histopatologického vyšetrenia išlo o tubulárny adenóm s nízkym stupňom dysplázie.
Otázky ku kazuistike:
Ktorá z dvoch vykultivovaných baktérií bola najpravdepodobnejšie zodpovedná za klinické príznaky pacienta?2. Prečo sa pacientov stav nezlepšoval po terapii gentamicínom?
1. Ktorá z dvoch vykultivovaných baktérií bola najpravdepodobnejšie zodpovedná za klinické príznaky pacienta?
2. Prečo sa pacientov stav nezlepšoval po terapii gentamicínom?
3. Ktoré klinické príznaky a ktoré výsledky laboratórnych testov pomohli stanoviť správnu diagnózu? Aká to bola diagnóza?
4. Aká antibiotická terapia by sa mala zvoliť na základe výsledkov hemokultivačného vyšetrenia? Ako dlho by mala trvať?
5. Aká terapia by sa mala zvoliť, ak by bol pacient alergický na penicilín, alebo ak by bol kmeň enterokoka rezistentný voči ampicilínu?
6. Čo bolo najpravdepodobnejším zdrojom pacientovej infekcie a čo bolo bránou vstupu?
7. Dajú sa u pacienta identifikovať predisponujúce faktory, zvyšujúce riziko opísanej infekcie?
8. Hrozí pacientovi v budúcnosti opakovanie takejto infekcie? Dá sa jej aspoň čiastočne predísť?
9. Poznáte aj rýchlejšie metódy detekcie pôvodcu v krvi a detekcie niektorých mechanizmov rezistencie v porovnaní s hemokultúrou a konvenčnými laboratórnymi testami citlivosti?
Enterococcus faecalis. Spoločný výskyt endokarditídy vyvolanej enterokokom a cystitídy vyvolanej kmeňom E. coli sa tiež nedá úplne vylúčiť, pretože u pacienta sa zistila pyúria a signifikantná (i keď asymptomatická) bakteriúria.
Pôvodcom endokarditídy bol kmeň E. faecalis, aj keď nie je možné úplne vylúčiť ani súbežne prebiehajúcu infekciu močových ciest kmeňom E. coli. Pre primárnu rezistenciu enterokokov voči bezpečným netoxickým koncentráciám aminoglykozidov sa gentamicín používa pri terapii enterokokových infekcií iba v kombinácii s antibiotikami inhibujúcimi syntézu bunkovej steny baktérií.
Zvýšený počet leukocytov, zvýšená sedimentácia a CRP svedčia o prebiehajúcom zápale v organizme. Pozitívna hemokultúra hodnotená v súvislosti s klinickým stavom pacienta a výsledkami echokardiografie jednoznačne viedli k diagnóze infekčnej endokarditídy vyvolanej kmeňom E. faecalis.
Terapia kombináciou ampicilínu s gentamicínom; podľa klinického stavu pacienta a rýchlosti jeho zlepšovania by antibiotická liečba mala trvať aspoň tri týždne.
Kombinácia vankomycínu a gentamicínu.
Enterokoky kolonizujúce črevný trakt; bránou vstupu bola pravdepodobne adenomatózna lézia črevnej sliznice.
Poškodenie srdcovej chlopne a jej funkcie, tubulárny adenóm črevnej sliznice.
Áno; zvýšená pozornosť sa musí venovať pacientovi pri invazívnych procedúrach na prirodzene osídlených slizniciach. Podanie antibiotík pred takýmto druhom zákrokov znižuje riziko hematogénneho prenosu baktérií a ich uchytenia na poškodenom povrchu endokardu.
Real-time PCR, multiple-PCR, DNA-array, panbakteriálna (a panfungálna) PCR
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
U 1-dňového novorodenca, ktorý sa narodil predčasne v 28 týždni gestácie cestou do pôrodnice, sa začala rozvíjať respiračná insuficiencia a príznaky sepsy. Matka udávala niekoľkodňový intermitentný únik tekutiny z vagíny v období tesne pred pôrodom. Dieťaťu sa začala podávať kombinácia cefotaximu s amikacínom a podporná liečba. Pred prvou dávkou antibiotík sa odobrala krv na hemokultiváciu . Klinický stav novorodenca sa však naďalej zhoršoval, preto bolo nevyhnutné vykonať intubáciu a zaviesť umelú pľúcnu ventiláciu. Antibiotická liečba sa zmenila na kombináciu amikacínu a piperacilínu s tazobaktamom. Klinický stav sa po miernom zlepšení začal opäť zhoršovať. V tom období už boli k dispozícii výsledky hemokultivácie – izoloval sa kmeň Enterococcus faecium. Predbežné testy citlivosti naznačovali rezistenciu voči vankomycínu, ampicilínu a vysokým hladinám gentamicínu a citlivosť na linezolid. Liečba sa okamžite zmenila na intravenózne podávaný linezolid. Dodatočné testy potvrdili výsledky predbežných testov citlivosti. Stav novorodenca sa začal rapídne zlepšovať, dieťa začalo samostatne prijímať materské mlieko, začalo priberať na váhe a po týždni bolo v dobrom stave prepustené z nemocnice.
Otázky ku kazuistike:
- Čo by mala obsahovať empirická antibiotická liečba novorodeneckej sepsy a meningitídy? Bola by v opísanom prípade účinná?
- Aké predispozičné faktory pre enterokokovú sepsu boli prítomné u novorodenca?
- Aké zdroje infekcie prichádzajú do úvahy pri novorodeneckej enterokokovej sepse? Ktorý zdroj by bol najpravdepodobnejší v prípade polyrezistentného kmeňa E. faecium, izolovaného z krvi novorodenca?
- Aké opatrenia je potrebné urobiť v prípade izolácie enterokoka rezistentného voči vankomycínu?
- Aká je prevencia infekcií vyvolaných kmeňmi VRE?
(Podľa: Ahuja S, Pandey A, Asthana AK, Chauhan K, Ritika, Madan M: Vancomycin-resistant Enterococcus faecium: Report of two cases. Indian Journal of Medical Microbiology. CASE REPORT. 32, 2014, 340-343. Upravené.)
Mala by sa podať kombinácia cefalosporínu 3. generácie a aminopenicilínu (je potrebné myslieť aj na prítomnosť Listeria monocytogenes, ktorá je na liečbu cefalosporínmi rezistentná); v záujme zvýšeného účinku sa môže pridať synergicky pôsobiace aminoglykozidové antibiotikum; táto kombinácia je nevyhnutná v prípade enterokokových infekcií, pretože penicilíny majú na enterokoky iba bakteriostatický účinok. V opísanom prípade by ani táto empirická liečba nebola účinná (pôvodcom bol E. faecium, primárne rezistentný voči cefalosporínom a so získanou rezistenciou voči penicilínom a vysokým hladinám aminoglykozidov).
Predčasný pôrod, unikanie plodovej vody počas niekoľkých dní pred pôrodom, ??? pôrod v sanitke.
Intestinálna a vaginálna kolonizácia matky enterokokmi, prostredie sanitky, nemocničné prostredie, nemocničný personál; vzhľadom na izolovaný polyrezistentný kmeň je asi najpravdepodobnejším zdrojom prostredie nemocnice (prípadne aj sanitky).
Izolácia pacienta, bariérové ošetrovanie, dôsledné dodržiavanie nemocničnej hygieny. Zároveň je potrebné zistiť možný zdroj infekcie a spôsob prenosu na pacienta.
Vzhľadom na to, že enterokoky prirodzene osídľujú viaceré sliznice človeka, endogénne infekcie nie sú úplne preventabilné. Dôležitou prevenciou je dodržiavanie správnych ošetrovateľských techník, nemocničná hygiena a umývanie rúk, izolácia alebo kohortácia pacientov infikovaných alebo osídlených VRE kmeňmi a ich bariérové ošetrovanie. Prevencia nozokomiálneho šírenia VRE a multirezistentných kmeňov enterokokov má prvoradý význam, pretože kmene druhov E. faecalis a E. faecium rezistentné voči vankomycínu, ktoré už kolonizovali gastrointestinálny trakt, je veľmi ťažké eradikovať.
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
Risson a kol. (Risson DC, O’Connor ED, Guard RW, et al. A fatal case of necrotising pneumonia due to community-associated methicillin-resistant Staphylococcus aureus. Med J Aust 186: 479–480, 2007) opísali prípad 23-ročnej ženy, ktorá vyhľadala pohotovostnú lekársku službu pre akútnu bolesť krížov a napriek tachykardii a horúčke bola odoslaná do domácej starostlivosti. O dva dni sa vrátila pre pretrvávajúcu bolesť v krížoch a pridruženú dýchavičnosť, zvracanie, myalgiu, horúčku, potenie sa, suchý kašeľ a bolesti v prednej časti hrudníka. Na ľavom lakti mala erytematóznu léziu a v rodinnej anamnéze uviedla opakovaný výskyt hnisavých kožných vyrážok u členov rodiny. Pacientku hospitalizovali a pri prijatí do nemocnice bola tachykardická a febrilná, s hypotenziou a tachypnoe, čo si vyžiadalo podporu dýchania cez masku. Na ľavom lakti bol diagnostikovaný furunkul. Laboratórne vyšetrenia preukázali leukocytózu s prevahou neutrofilov, trombocytopéniu, koagulopatiu, zvýšené zápalové parametre, renálnu dysfunkciu, zvýšenú hladinu kreatinínu a snímka pľúc ukázala bilaterálne zatienenie pľúc. Na mikrobiologické vyšetrenie sa zaslala krv na hemokultiváciu, endotracheálny aspirát a výter z furunklu s biopsiou. Empiricky sa podal intravenózny tikarcilín (širokospektrálny penicilín) s klavulanátom, gentamicín a azitromycín a začalo sa s podpornou liečbou na udržanie vitálnych funkcií. Následne sa podali aj 2g dikloxacilínu (protistafylokokový penicilín). O 6 hodín po prijatí sa pacientka respiračne zhoršila, musela sa intubovať a zaviedla sa jej mechanická ventilácia. Hypotenzia napriek intenzívnej liečbe naďalej pretrvávala. 14 hodín po prijatí hlásilo mikrobiologické laboratórium mikroskopický nález stafylokokov v pozitívnej hemokultúre a pacientke sa začal intravenózne podávať vankomycín. 16 hodín po prijatí sa u pacientky objavila ventrikulárna tachykardia a napriek resuscitácii o hodinu zomrela. Mikrobiologické vyšetrenie dokázalo prítomnosť kmeňa S. aureus rezistentného voči meticilínu (MRSA kmeň) vo všetkých zaslaných vzorkách. Kmeň bol citlivý na viacero antibiotík, vrátane erytromycínu, klindamycínu, gentamicínu, tetracyklínu, ciprofloxacínu a vankomycínu. Všetky izoláty boli schopné produkovať Pantonov-Valentinov leukocidín. Neskôr sa odobrali výtery nosovej sliznice ďalších troch členov rodiny pacientky (dvaja z nich trpeli rekurentnou furunkulózou) a vo všetkých sa dokázal rovnaký kmeň MRSA.
Otázky ku kazuistike:
1. Pomohlo by mikroskopické vyšetrenie krvi hneď po odbere urýchliť detekciu pôvodcu?
2. Preukázalo by mikroskopické vyšetrenie vzoriek z furunklu stafylokoky?
3. Mal by mikroskopický nález grampozitívnych kokov v endotracheálnom aspiráte diagnostickú hodnotu?
4. Aké mikrobiologické diagnostické metódy by mohli rýchlejšie odhaliť pôvodcu?
5. Mal kmeň MRSA izolovaný od pacientky nozokomiálny pôvod?
6. Líšil sa pacientkin kmeň MRSA od typických nozokomiálnych kmeňov MRSA?
7. Akým spôsobom sa mohol dostať kmeň MRSA do pacientkiných pľúc?
8. Prečo sa stav pacientky nezlepšoval ani napriek tomu, že sa jej krátko po hospitalizácii podala empirická antibiotická terapia a jej kmeň MRSA bol citlivý na dve (gentamicín, azitromycín) zo štyroch empiricky podaných antibiotík?
9. Ktoré faktory virulencie pacientkinho kmeňa boli pravdepodobne zodpovedné za jeho invazívnosť a rýchlu progresiu ochorenia?
10. Aký ďalší benefit okrem antibakteriálnej aktivity poskytujú liečivá, ktoré inhibujú bakteriálnu proteosyntézu (napr. azitromycín)?
11. Rovnaký kmeň MRSA sa dokázal aj u ďalších členov rodiny pacientky. Odporúčali by ste dekolonizáciu? Bola by určite úspešná? Aký neantibiotický prípravok by bol vhodný na ich dekolonizáciu?
Nie. Pri sepse je v krvi dospelých pacientov obvykle len veľmi malé množstvo baktérií (menej než 1 baktéria/ml krvi) a citlivosť mikroskopického vyšetrenia je okolo 103 – 104/ml vzorky. Preto je potrebné, aby sa baktérie v hemokultúre najprv rozmnožili kultiváciou v hemokultivačnoum systéme. Mikroskopické vyšetrenie krvi a jej inokulácia na pevné kultivačné pôdy sa uskutoční až potom, čo hemokultivačný systém signalizuje prítomnosť metabolickej aktivity (t.j. rast baktérií) vo vzorke.
Pravdepodobne áno. Prítomnosť leukocytov a neprítomnosť epitelových buniek umožní posúdiť kvalitu odberu a zápalovú aktivitu.
Endotracheálny aspirát môže obsahovať kontaminujúce baktérie, ktoré kolonizujú horné dýchacie cesty (patria k nim aj stafylokoky). Jednoznačná interpretácia by preto nebola možná. Nález polymorfonukleárnych leukocytov obsahujúcich sfagocytované grampozitívne koky by pomohol pri interpretácii.
Rýchlejšie by sa pôvodca mohol detegovať v krvi metódami molekulárnej biológie (PCR zameraná na nukleotidové sekvencie špecifické pre druh S. aureus a na detekciu mecA génu, alebo panbakteriálna PCR).
Nie. Pacientka nebola pred vypuknutím príznakov infekcie hospitalizovaná aspoň 48 hodín.
Áno. Bol citlivý na viacero ďalších antibiotík a bol schopný produkovať PVL (mal vyššiu virulenciu).
Pravdepodobne hematogénnou cestou z ložiska v koži alebo v mäkkých tkanivách. Svedčia o tom aj systémové príznaky infekcie (tachykardia a horúčka) pri pacientkinej prvej aj druhej návšteve lekárskej pohotovosti. Ďalšou možnosťou by bola aspirácia z kolonizovaných horných dýchacích ciest.
Pravdepodobne pre pokročilý stupeň sepsy a rozvíjajúci sa septický šok (hypotenzia rezistentná na antihypotenznú intenzívnu terapiu). V prípade závažných infekcií sa odporúča použitie synergickej kombinácie antibiotík inhibujúcich syntézu bunkovej steny s aminoglykozidmi. Baktéria bola citlivá na gentamicín, ale voči spoločne podaným betalaktámovým antibiotikám (tikarcilín/klavulanát a dikloxacilín) bola rezistentná. Účinný vankomycín sa začal podávať až o 14 hodín.
Pantonov-Valentinov leukocidín, alfa-toxín a zvýšená produkcia týchto toxínov.
Uvedené antibiotiká potláčajú bakteriálnu proteosyntézu, teda aj tvorbu bakteriálnych toxínov, preto sa odporúča ich použitie (aj v kombinovanej terapii) v prípade závažnej infekcie vyvolanej toxinogénnym bakteriálnym kmeňom.
Áno, dekolonizácia spolu s liečbou chronickej furunkulózy by bola vhodná. U niektorých nosičov kmeňa Staphylococcus aureus je dekolonizácia len dočasná, ale následne už nemusia byť kolonizovaní kmeňom, ktorý je rezistentný voči meticilínu. Na dekolonizáciu by sa mohlo použiť lokálne antiseptikum alebo prípravok obsahujúci protistafylokokové fágy.
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
67-ročnej pacientke dva týždne liečenej lokálnou aplikáciou cytostatikami na prekancerózne lézie na koži tváre sa začali vytvárať žlté krusty na povrchu ošetrovanej kože, ktoré svojou štruktúrou, farbou ani hrúbkou nezodpovedali obvyklej reakcii na aplikovanú liečbu. Na báze lézií a na ich leme bol výrazný erytém. Pacientka udávala pocit svrbenia a pálenia postihnutej oblasti, nemala teplotu ani žiadne iné systémové príznaky. Lekár odobral materiál na mikrobiologické vyšetrenie. Mikrobiologické laboratórium na druhý deň hlásilo masívny kultivačný záchyt Staphylococcus aureus a Streptococcus pyogenes a na ďalší deň výsledky citlivosti na antibiotiká. Pacientke sa ukončilo podávanie cytostatika a odobral sa výter nosovej sliznice, ktorý bol tiež kultivačne pozitívny na Staphylococcus aureus. Po antibiotickej liečbe sa pacientkin stav zlepšil a lézie sa úplne vyhojili.
Otázky ku kazuistike:
1. Aká bola klinická diagnóza?
2. Aký materiál sa odoberá v takýchto prípadoch a ako sa zasiela do mikrobiologického laboratória?
3. Prečo sa dodatočne odobral aj výter z nosovej sliznice?
4. Čo bolo najpravdepodobnejším zdrojom infekcie pacientky?
5. Čo bolo bránou vstupu infekčného agensu?
6. Aká liečba by sa mala v pacientkinom prípade aplikovať?
7. Aké ďalšie opatrenia by sa mali urobiť?
8. Akým spôsobom by sa mohla dekolonizovať nosová sliznica pacientky?
9. Do ktorej vekovej kategórie patria obvykle pacienti s touto diagnózou?
(Prípad je modelový.)
Impetigo.
Ster z kožnej lézie; zasiela sa v skúmavke s transportným médiom.
Pátralo sa pravdepodobnom zdroji infekcie.
V prípade S. aureus nosičstvo na nosovej sliznici, môže sa však uvažovať aj o kontakte s iným nosičom, alebo s kontaminovaným prostredím. V prípade Streptococcus pyogenes by to mohol byť priamy kontakt s infikovaným človekom alebo nosičom (najpravdepodobnejšie vnúčatá alebo iný člen rodiny – mikrobiologicky sa nevyšetrovali), možný je však aj kontakt s kontaminovanými predmetmi.
Kožný kryt poškodený lokálnou cytostatickou liečbou.
Lokálne antibiotiká a antiseptiká. Pacientke sa na základe výsledkov citlivosti podával lokálne neomycín s bacitracínom.
Zvýšiť osobnú hygienu a hygienu prostredia, dekolonizovať nosovú sliznicu.
Lokálnou aplikáciou dezinfekčných prostriedkov (napr. jódpovidon), antibiotík (mupirocín, bacitracín), kombináciou lokálnej kyseliny fusidovej a ďalšieho antibiotika (pri monoterapii kyselinou fusidovou je prítomné riziko vzniku rezistentných mutantov), alebo protistafylokokovými fágmi.
Deti predškolského veku.
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
15-ročné dievča navštívilo lekársku pohotovosť pre horúčku, nevoľnosť, zvracanie, bolesti brucha a hlavy. Príznaky sa objavili pred troma dňami a postupne sa zhoršovali. Vyšetrenie preukázalo horúčku 39,5 °C, hypotenziu, tachykardiu a výraznú dehydratáciu. Pacientku hospitalizovali a okamžite zaviedli intravenóznu rehydratáciu. Onedlho sa objavila erytematózna kožná vyrážka na trupe a končatinách a drobné tmavé krvácajúce lézie na sliznici dutiny ústnej a vagíny. Pre trombocytopéniu a anémiu sa podala transfúzia a empiricky intravenózne ceftriaxon. Pred prvou dávkou antibiotika sa odobral materiál na mikrobiologické vyšetrenie (krv na hemokultiváciu, moč, výter rekta, faryngeálny a vaginálny výter) a pacientka sa premiestnila na jednotku intenzívnej starostlivosti, pretože sa jej stav začal rýchlo zhoršovať – vznikol systémový šokový stav so zmeneným stavom vedomia a hypotenzia vyžadujúca aplikáciu vazopresorov. Pacientke sa zaviedla umelá pľúcna ventilácia a pridal sa intravenózne vankomycín. Naďalej však pretrvávala horúčka, difúzny kožný erytém a rozvinulo sa multiorgánové zlyhanie, extenzívna deskvamácia vulvy, gluteálnej oblasti, stehien a erózia vaginálnej sliznice. Kultivačné výsledky odobratých biologických vzoriek boli negatívne, s výnimkou vaginálneho výteru, v ktorom sa dokázala prítomnosť kmeňa Staphylococcus aureus citlivého na oxacilín aj na klindamycín. Klinický stav, kultivačný nález a informácia o menštruácii tesne v predchorobí, počas ktorej pacientka používala menštruačné tampóny, viedli k spresneniu diagnózy. Pokračovalo sa v intenzívnej starostlivosti a upravila sa antibiotická liečba. Pacientkin stav sa postupne zlepšil a do domáceho ošetrenia bola prepustená o dva týždne.
Otázky ku kazuistike:
- Aká bola konečná diagnóza?
- Čo bolo patogenetickou príčinou pacientkinho život ohrozujúceho stavu?
- Opíšte patogenézu pacientkinho ochorenia.
- Aké ďalšie klinické príznaky okrem už opísaných môžu byť prítomné?
- Aké predispozičné faktory boli u pacientky prítomné?
- Môže sa opísané ochorenie prejaviť aj u detí a mužov? Kde sa v takýchto prípadoch vyskytuje producent toxínu?
- Aké dodatkové testy je potrebné urobiť po izolácii kmeňa S. aureus z biologického materiálu pacienta pre potvrdenie klinickej diagnózy?
- Aká je liečba pacientkinho ochorenia?
- Aká je prevencia?
(Podľa: LeRiche T, Black A., Fleming N.: Toxic Shock Syndrome, a Gynecological Source in an Adolescent: A Case Report. Journal of Pediatric & Adolescent Gynecology, 24, 2011, 69-70.)
Stafylokokový toxický šok asociovaný s menštruáciou.
TSST-1 vyprodukovaný počas menštruácie vaginálnym nosičským kmeňom S. aureus.
Toxinogénny kmeň S. aureus, kolonizujúci vaginálnu sliznicu, vyprodukoval počas menštruácie v prítomnosti menštruačného tampónu vo vagíne vysoké množstvá TSST-1. Toxín sa adsorboval vaginálnou sliznicou a prestúpil do krvného obehu. Pretože TSST-1 má vlastnosti superantigénu, začal polyklonálne aktivovať Th lymfocyty a makrofágy, čo viedlo k masívnemu uvoľneniu prozápalových cytokínov (IFN-gama, TNF, IL-1, IL-2). Uvoľnené cytokíny boli mediátorom klinických príznakov pacientky.
Okrem horúčky, nevoľnosti, zvracania, bolesti brucha a hlavy aj bolesť hrdla a myalgia. Erytém, šokový stav, multiorgánové zlyhanie, ako aj následná deskvamácia, sa objavujú neskôr.
Kolonizácia vaginálnej sliznice toxinogénnym kmeňom S. aureus (t.j. schopným produkovať TSST-1), používanie tampónu počas menštruácie, neprítomnosť protilátok proti TSST-1.
Áno, zdrojom toxínu je obvykle kmeň S. aureus infikujúci ranu alebo kolonizujúci sliznicu respiračného traktu.
Dôkaz tvorby TSST-1 / génu pre TSST-1 v izolovanom kmeni S. aureus, prípadne aj dôkaz toxínu v sére alebo v moči pacienta.
Intenzívna starostlivosť – intravenózna hydratácia, vazopresory, podpora funkcií zlyhávajúcich orgánov. Antibiotická liečba - antibiotiká, ktoré inhibujú proteosyntézu a majú tak pozitívny vplyv na potlačenie tvorby toxínu (klindamycín, linezolid); môžu sa podávať s protistafylokokovými betalaktámami, alebo s vankomycínom v prípade kmeňa MRSA. Intravenózne podávané imunoglobulínové preparáty môžu pomôcť pri inaktivácii voľných molekúl TSST-1 v krvnom obehu.
Nepoužívať tampóny počas menštruácie; rizikové môžu byť aj ďalšie intravaginálne uložené cudzie telieska.
Správne ošetrenie kožných lézií a rán.
Autor: Hubenáková Z.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
24 ročnej študentke medicíny s príznakmi zvracania, nevoľnosti a abdominálnymi kŕčmi sa príznaky objavili náhle, cca 1,5 hodiny po požití cestovín pripravených z predošlého dňa. Jednalo sa o cestoviny, ktoré v deň ich prípravy boli dlhšiu dobu (niekoľko hodín) po úprave a čiastočnom skonzumovaní ponechané pri izbovej teplote a zabudnuté na sporáku a následne boli uložené do chladničky. V nasledujúcom dni si ich študentka jednoducho ohriala v mikrovlnnej rúre. Vzhľadom k rýchlemu odozneniu klinických príznakov do nasledujúceho dňa pacientka aj vďaka domácej symptomatickej liečbe (Endiaron) nenavšívila zdravotnícke zariadenie.
Otázky ku kazuistike:
Stanovte predpokladaného pôvodcu potravinovej intoxikácie. Pomohla by Vám pri stanovení tohto pôvodcu ochorenia informácia o prípadnej konzumácii (podobnej potraviny takisto s obsahom škrobu) ryže kontaminovanej spórami baktérií, ktorá takisto po uvarení bola dlho ponechaná pri izbovej teplote s následným klíčením odolných spór a ich transformáciou na vegetatívne bunky s produkciou termostabilného emetického toxínu, ktorý aj po jej ohriatí pretrval v potravine?
- Je nevyhnutné pri tomto type ochorenia vyhľadať lekársku pomoc a zahájiť antibiotickú terapiu?
- Aký liečebný režim by ste odporúčili pacientke?
Bacillus cereus
Potravinová intoxikácia vyvolaná pôvodcom Bacillus cereus je samolimitujúce ochorenie, ktoré odoznie samovoľne aj bez liečby do 24 hodín. Nie je nutné vyhľadať lekársku pomoc, antibiotická liečba nie je zahájená.
Liečba je symptomatická a je založená na rehydratácii, diéte, pokoji na lôžku, prínosom by mohlo byť živočíšne uhlie so schopnosťou náväznosti toxínov, alebo črevné dezinficiens (Endiaron)
Autor: Hubenáková Z.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
V období po intenzívnych dažďoch so záplavami sa na pravej ruke pracovníka na farme po manipulácii s dobytkom prejavujúcim príznaky zatiaľ bližšie nešpecifikovanej choroby vyvinula čierna lézia obklopená masívnym edémom. Ochorenie bolo diagnostikované ako kožná forma antraxu. Doplňujúcou informáciou je, že dobytok na uvedenej farme sa od začiatku jari do konca jesene pasie voľne na lúkach.
Otázky ku kazuistike:
1. Je antrax na Slovensku častým ochorením zvierat a ľudí?
2. Uveďte ako mohlo najpravdepodobnejšie prísť k prenosu tohto ochorenia na pracovníka zvieracej farmy?
3. Aké antibakteriálne liečivá by sa mali použiť pri empirickej liečbe tohto pacienta?
4. Aká je prognóza kožného, gastrointestinálneho a pľúcneho antraxu?
5. Aká dlhá je inkubačná doba antraxu?
6. Aké sú možnosti prevencie antraxu?
7. Prečo pravdepodobne ochoreli zvieratá z farmy, kde pracoval pacient?
Antrax nie je na Slovensku endemický.
Pracovník zvieracej farmy mal pravdepodobne na rukách drobné mikrotraumy, ktorými došlo k prieniku pôvodcu antraxu do kože.
Na liečbu kutánneho antraxu je možné použiť amoxicilín. V prípade alergie na penicilíny sú vhodným liečivom fluorochinolóny (ciprofloxacín) alebo tetracyklíny (doxycyklín).
Prognóza antraxu závisí od formy ochorenia. Pri včasnej liečbe a nekomplikovanom priebehu kožného antraxu je prognóza dobrá a vedie k vyliečeniu, pľúcny a gastrointestinálny antrax majú často letálny priebeh aj napriek liečbe.
Inkubačná doba závisí od formy ochorenia. Najčastejšie sa pohybuje v rozmedzí od dvoch do siedmich dní (najčastejšie trvá viac ako 3 dni), pri pľúcnom antraxe môže byť kratšia.
Primárna prevencia sa uskutočňuje u zvierat – v prípade výskytu protiepidemické opatrenia, vakcinácia, veterinárne prehliadky. Preventívny význam má aj karanténa dovezených zvierat.
Pravdepodobne to súvisí s intenzívnymi dažďami a záplavami, ktoré mohli vymyť zo zeme antraxové spóry v oblastiach, kde sa v minulosti pochovávali zvieratá uhynuté na antrax.
Autor: Hubenáková Z.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
47 ročný pacient v 2. klinickom štádiu HIV infekcie (počet CD4+ T lymfocytov 250 buniek/1 µl krvi) prišiel k lekárovi po neúspešnej domácej samoliečbe analgetikami s antipyretickým účinkom pre niekoľko dní trvajúce horúčky (38,2 °C) a postupne sa zhoršujúce neznesiteľné bolesti hlavy s pridruženou nevoľnosťou až pocitom na zvracanie. Pacient udal, že spomínaným príznakom u neho predchádzala približne 7 dní predtým konzumácia mäkkých syrov typu Camembert a Brie, ktoré požil spolu s hroznom pri ochutnávke kvalitného bieleho vína, ktoré dostal na svoje meniny. Diagnóza pacienta bola stanovená ako meningitída, pričom u pacienta bola zahájená lumbálna punkcia likvoru. Likvor bol makroskopicky mierne zakalený. Vzhľadom k predpokladanému pôvodcovi ochorenia a jeho možnej nízkej kvantite v biologickom materiáli a vzhľadom k rýchlosti samotného testovania, bola okrem štandardnej mikrobiologickej diagnostiky založenej na mikroskopii, kultivácii, biochemickej identifikácii a stanovenia antibiotickej citlivosti použitá aj metodika real-time PCR. Po úspešnej kultivácii bol patogén stanovený biochemickými testami ako Listeria monocytogenes u ktorého bol následne vykonaný test citlivosti na antibiotiká.
Otázky ku kazuistike:
- Mohli by byť v empirickej liečbe listériovej meningitídy indikované samotné cefalosporíny 3. generácie?
- Aké 2 faktory predisponujú tohto pacienta k uvedenému klinickému stavu?
- Listériová meningitída patrí k preventabilným ochoreniam. Uveďte ako jednoducho mu možno predchádzať.
- Ktoré skupiny pacientov sú v najväčšom riziku listériovej infekcie vedúcou až k meningitíde a prečo?
V liečbe listériovej meningitídy nemožno samostatne podať cefalosporíny 3. generácie nakoľko listérie sú primárne rezistentné k cefalosporínom. Avšak pacientom z rizikových skupín pre vznik tohto ochorenia sa empiricky odporúča kombinácia cefalosporínu 3. generácie s ampicilínom pre ich synergický efekt.
Imunodeficit pacienta a konzumácia nepasterizovaných mäkkých plesňových syrov.
Pacienti s imunodeficitom ako aj imunosuprimovaní pacienti by sa mali vyhýbať pitiu nepasterizovaného mlieka a požívaniu z neho vyrobených produktov ako aj mäsovým výrobkom (ako napr. párky), ktoré neprešli tepelnou úpravou.
Novorodenci a počas samotného tehotenstva plod tehotnej ženy, na ktorých sa listerióza manifestujúca sa ako meningitída a sepsa môžu preniesť perinatálne, alebo transplacentárne, imunokompromitovaní HIV infikovaní pacienti a pacienti na imunosupresívnej terapii (pacienti po transplantácii, onkologickí pacienti). U týchto pacientov zohráva hlavnú úlohu ich výrazné oslabenie imunity.
Autor: Hubenáková Z.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
Pracovník rybieho trhu sa po pár dňoch od objavenia erytematózneho spočiatku bolestivého a neskôr svrbiaceho zapáleného ostroohraničeného ložiska lokalizovaného na prste pravej ruky hlásil u lekára. Lézia s jemným nádychom do fialova mala mierne zvýšené okraje a bola obkolesená miernym edémom. Po dôkladnej anamnéze lekár zistil, že sa jedná o zamestnanca rybieho trhu, ktorý pracuje ako čistič a spracovateľ rýb a morských plodov a počas spracovania rybacieho mäsa sa porezal nožom avšak nemal možnosť bezprostrednej dezinfekcie rany. Následne boli odobraté stery z okraja lézie ako aj hlboký ster z jej stredu a pre podozrenie na erisipeloid bol z postihnutého miesta odobratý aj aspirát. Po predĺženej kultivácii bol mikroorganizmus identifikovaný biochemickými testami ako Erysipelothrix rhusiopathiae.
Otázky ku kazuistike:
- Dalo by sa ochorenie zvládnuť aj bez antibiotickej terapie?
- Aké antibiotikum je liekom voľby pre erysipeloid?
- Aké ochranné pracovné pomôcky by ste odporučili tomuto pracovníkovi? Mohli by byť v prevencii prínosné aj nejaké hygienické opatrenia a pod.?
Hoci po niekoľkých týždňoch od objavenia erysipeloidu dochádza k jeho spontánnemu vyhojeniu, avšak pre možné relapsy a riziko progresie do vážnejšej formy (difúzna kožná forma, endokarditída) je vhodné toto ochorenie preliečiť antibiotikami.
Liekom voľby lokalizovanej kutánnej infekcie (erysipeloidu) je perorálny penicilín V.
Predovšetkým rukavice, ochrannú zásteru a takisto je dôležité si často umývať ruky (najlepšie dezinfekčným mydlom) a mať vždy po ruke dezinfekciu.
Autor: Hubenáková Z.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
U tehotnej ženy sa približne mesiac po pobyte v Tatrách vyvinuli chrípke podobné príznaky. Pacientka v anamnéze uviedla návštevu salaša, kde v reštauračnej časti skonzumovala viacero druhov mäkkých syrov a bryndzu, ktoré neprešli procesom pasterizácie.
Diagnóza: suspektná listerióza, neskôr laboratórne potvrdená.
Otázky ku kazuistike:
1. Čo bolo najpravdepodobnejším prameňom pôvodcu a bránou vstupu infikujúcich baktérií?
2. Akým spôsobom by mohla intrauterinná listériová infekcia ohroziť vývoj plodu?
3. Aké opatrenie by ste navrhli s cieľom prevencie transplacentárneho prenosu infekcie na plod?
4. Ktorým skupinám osôb by ste odporučili vyhnúť sa pitiu nepasterizovaného mlieka a produktov z neho pripravených?
Konzumácia rizikových potravín sa neodporúča tehotným ženám, starým ľuďom a imunokompromitovaným pacientom.
5. Prečo je možné nakaziť sa listeriózou napriek uskladneniu rizikových potravín v chladničke?
Bránou vstupu listériovej infekcie je najčastejšie tráviaci trakt, listerióza je typická alimentárna nákaza. Človek sa infikuje po požití kontaminovanej potravy (nepasterizované mlieko alebo produkty z neho vyrobené), ktorá predstavuje zdroj infekcie. K prenosu infekcie z tehotnej ženy na plod dochádza transplacentárne počas bakteriémie gravidnej ženy, alebo sa novorodenec nakazí perinatálne kontaktom s listériou, ktorá sa dočasne nachádza v črevnom trakte matky alebo na jej vaginálnej sliznici.
Intrauterinná listerióza vedie k zápalovému poškodeniu plodu so sepsou a mnohopočetnými granulomatóznymi léziami v parenchymatóznych orgánoch.
Tehotné ženy by sa mali vyhýbať konzumácii nepasterizovaného mlieka a mliečnych výrobkov z neho vyrobených (hlavne mäkkých zrejúcich syrov a nepasterizovanej bryndze), ako aj konzumácii tepelne nedostatočne upravených mäsových výrobkov (napr. párkov, salám, soleného sušeného mäsa a pod.). V prípade infekcie je dôležité čo najskôr začať antibiotickú terapiu, ktorá v lepšom prípade zabráni infekcii plodu a v horšom minimalizuje následky intrauterinnej infekcie.
Konzumácia rizikových potravín sa neodporúča tehotným ženám, starým ľuďom a imunokompromitovaným pacientom.
Listeria monocytogenes je baktéria schopná množiť sa aj pri 4°C v chladničke a dosiahnuť tak infekčnú dávku potrebnú pre vyvolanie infekcie u človeka.
Autor: Poľanová M.1, Solovič I.2, Porvazník I.1
Pracovisko: 1Oddelenie klinickej mikrobiológie, imunológie a alergológie Národného ústavu tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie Vyšné Hágy, 2Oddelenie pneumológie a ftizeológie I Národného ústavu tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie Vyšné Hágy
Kazuistika
47 ročná pacientka prijatá pre pneumóniu s výpotkom:
– od roku 1998 liečená pre reumatoidnú artritídu (liečba v minulosti Metotrexátom a Prednisonom);
– od roku 2006 podávaná anti-TNF liečba pre primárne autoimúnne ochorenie;
– v roku 2004 hysterektómia a adnexektómia vpravo;
– 19.3.2007 – adnexektómia vľavo pre suspektnú generalizovanú karcinomatózu.
Histologicky a mikrobiologicky verifikovaná generalizovaná tuberkulóza vnútorného genitálu a kazeózna diseminácia do peritonea. Pridružila sa pneumónia a ascites. Pacientka prijatá do špecializovanej nemocnice pre TBC a ochorenia pľúc z iného spádového zdravotníckeho zariadenia vo vážnom stave, s pneumóniou, pridružená je závažná hypoproteinémia, hypoalbuminémia, kardiálna dekompenzácia, bilaterálny fluidotorax, dehiscenia operačnej rany. Prechodne hospitalizovaná na JIS, po stabilizácii preklad na gynekologické oddelenie. Podávaná antituberkulózna liečba spolu s kortikoterapiou Prednisonom a antimalarikom Plaquenilom a vykonávané opakované kontroly. Po 9 mesiacoch antituberkulózna liečba ukončená, klinický stav zlepšený.
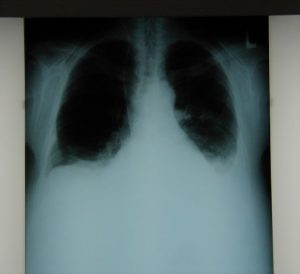
RTG snímka pri prijatí
(autor: Monika Poľanová)
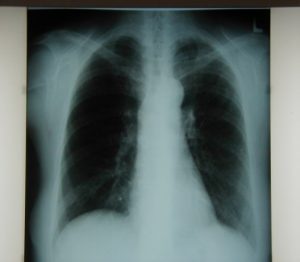
RTG snímka pri prepustení
(autor: Monika Poľanová)
Otázky ku kazuistike:
1. Čo bolo príčinou rozsiahleho výpotku?
2. Čo primárne komplikovalo stav pacientky a klinické prejavy ochorenia?
3. Ktoré testy by ste použili na stanovenie diagnózy?
4. Aké sú predisponujúce faktory vzniku takéhoto stavu?
5. Aká je pravdepodobnosť opätovného prepuknutia ochorenia a kedy?
6. Aké metódy detekcie patogéna by ste zvolili?
7. Akú liečbu by ste doporučili?
Príčinou rozsiahleho výpotku bola generalizovaná tuberkulóza vnútorného genitálu.
Biologická liečba a imunosupresia komplikovala pacientkin stav a klinické prejavy ochorenia.
Rýchle testy ako PCR a zrýchlená kultivácia a citlivosť umožnili stanovenie diagnózy (PCR na TBC komplex z operačného materiálu pozitívna, BACTEC MGIT kultivácia pozitívna).
Dlhodobá imunosupresia a opakovaný kontakt s patogénom umožní vznik takéhoto stavu.
Nedostatočne dlhá resp. prerušená liečba umožnia vznik opätovného prepuknutia ochorenia.
Mikroskopické, kultivačné a molekulárno genetické metódy sú určené na detekciu patogéna.
Základná štvorkombinácia antituberkulotík v štandardnom režime je najvhodnejším riešením, v prípade výskytu rezistencie volíme druholíniovú liečbu na základe výsledku testu citlivosti.
Autor: Poľanová M.1, Solovič I.2, Porvazník I.1
Pracovisko: 1Oddelenie klinickej mikrobiológie, imunológie a alergológie Národného ústavu tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie Vyšné Hágy, 2Oddelenie pneumológie a ftizeológie I Národného ústavu tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie Vyšné Hágy
Kazuistika
39 ročný pacient pracujúci v poľnohospodárstve, 9 rokov liečený pre chronickú autoimunitnú hepatitídu, liečba Prednisonom. Pacient bol prijatý do špecializovanej nemocnice pre TBC a ochorenia pľúc pre kašeľ a bolesti na hrudníku z iného spádového zdravotníckeho zariadenia vo vážnom stave. Symptómy pretrvávali viac ako 3 týždne. Pre subpleurálny fokus bol odoslaný na chirurgické riešenie. Rtg snímka odhalila difúzny retikulárny obojstranný nález, rozsiahlejší vpravo (obr. A). Pred operačným zákrokom sa vykonala bronchoalveolárna laváž a biopsia, s histologickým nálezom fibrotického tkaniva a mnohopočetných mikronodulov. V mikroskopickom obraze početné gramnegatívne filamentózne vláknité štruktúry s početnými grampozitívnymi granulami vo vnútri vláken; pri farbení na acido-alkoholo-rezistentné mikroorganizmy sa rovnako pozorovali slabo zafarbené vláknité filamentózne štruktúry. V krvnom obraze boli zvýšené zápalové markery, pretrvávala neutrofília a leukocytóza. Pri resekcii fokusu sa pozorovala obliterácia pľúcneho tkaniva zmnoženým fibrovaskulárnym tkanivom s mnohopočetnými mikroabscesmi (histologicky potvrdené). Pacient bol prechodne hospitalizovaný na JIS, po stabilizácii preložený na pneumologické oddelenie s diagnózou obojstrannej bronchopneumónie, diagnostikovaným granulomatóznym ochorením s množstvom mikronodulov a diseminiáciou. Empiricky sa začala podávať antimikrobiálna liečba. Kultivačne po predĺženej kultivácii z BAL a biopsie rast Nocardia asteroides (obr. B). Priebežne sa vykonávali opakované kontroly. Po 3 mesiacoch stav zlepšený, liečba ukončená po 9 mesiacoch, klinický stav normalizovaný.
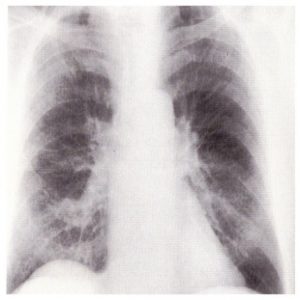
Obr. A: RTG snímka pacienta pri prijatí
(Foto: Monika Poľanová)
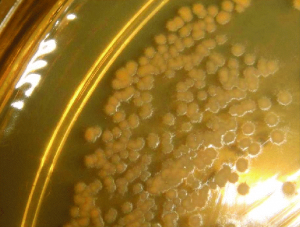
Obr. B: Kultivačný nález N. asteroides na živnom agare
(Foto: Monika Poľanová)
Otázky ku kazuistike:
1. Čo bolo príčinou rozsiahleho rtg obrazu?
2. Čo primárne komplikovalo pacientov stav a klinické prejavy ochorenia?
3. Ktoré testy by ste použili na stanovenie diagnózy?
4. Aké sú predisponujúce faktory vzniku takéhoto stavu?
5. Aké metódy detekcie a identifikácie patogéna by ste zvolili?
6. Akú liečbu by ste odporúčali?
Obojstranná bronchopneumónia (granulomatózny proces s disemináciou)
Dlhodobá liečba Prednisonom pre chronickú autoimunitnú hepatitídu.
Zobrazovacie metódy, mikroskopické vyšetrenie materiálu (farbenie podľa Grama a Ziehla-Neelsena), predĺžená kultivácia v atmosfére so zvýšenou tenziou CO2, dôkaz bakteriálnej nukleovej kyseliny, histologické vyšetrenie bioptických a perioperačných vzoriek.
Znížená imunita (napr. infekcia HIV, transplantácia - kostnej drene alebo orgánová, nádorové ochorenie, liečba imunosupresívami); základné ochorenie pľúc (napr. chronická bronchitída, emfyzém, astma, bronchiektázie, pľúcna proteinóza); drogová závislosť, alkoholizmus, bezdomovectvo; traumatické poškodenie kože (primárna kožná forma s rizikom diseminácie do pľúc); práca s kontaminovanou pôdou (zdroj nokardií).
Mikroskopická morfológia a farbiteľnosť, kultivačné vlastnosti, MALDI-TOF, sekvenácia
Kotrimoxazol a amikacín dlhodobo, t.j. 4-6 mesiacov (imunodeficientný pacient s pľúcnou formou nokardiózy; pacientovi sa podával tiež kotrimoxazol v kombinácii s amikacínom).
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
30-ročný muž navštívil lekára pre 3 dni trvajúcu bolesť pravej strany hrdla, ktorá vystreľovala do ucha a zintenzívňovala sa pri prehĺtaní. V anamnéze uviedol, že je fajčiarom, je sexuálne aktívny a v súčasnosti má stáleho mužského partnera. Pacient v minulosti už viackrát vyhľadal zdravotnícku pomoc pre opakovaný peritonzilárny absces a v jednom prípade sa mu diagnostikovala aj tonzilofaryngitída vyvolaná kmeňom N. gonorrhoeae.
Pacient bol pri návšteve lekára afebrilný, nemal príznaky infekcie horných dýchacích ciest, nebol zachrípnutý, negoval aj bolesti krku. Pri vyšetrení sa zistil spazmus čeľustných svalov, ktorý bránil pacientovi úplne otvoriť ústa. Pravá tonzila bola výrazne zväčšená, s erytémom, bez petechií alebo exsudátu. Bola prítomná krčná lymfadenopatia.
CT krku odhalila peritonzilárny absces rozmerov 2,5×2 cm. Vykonala sa incízia a drenáž abscesu, pri ktorej sa odobrali 2 ml hnisu a zaslali sa na mikrobiologické vyšetrenie.
Mikroskopické vyšetrenie preparátu hnisu zafarbeného podľa Grama ukázalo výskyt malých grampozitívnych paličiek, 48-hodinová kultivácia na krvnom agare v kapnofilných podmienkach masívny výskyt drobných bielosivých beta-hemolytických kolónií. Kmeň bol pomocou MALDI-TOF MS identifikovaný ako Arcanobacterium haemolyticum a vykonal sa test citlivosti na antibiotiká. Pacientovi sa nasadila antibiotická liečba v domácom ošetrení a navrhla sa mu tonzilektómia pre opakovaný výskyt peritonzilárneho abscesu.
Otázky ku kazuistike:
- Aké infekcie vyvoláva Arcanobacterium haemolyticum u človeka?
- S ktorými baktériami si možno pomýliť A. haemolyticum na základe klinických príznakov a výsledkov kultivácie na krvnom agare? Aké laboratórne testy umožnia jeho spoľahlivú identifikáciu?
- Kedy môže nastať situácia s falošne negatívnym kultivačným nálezom?
- Ako sa liečia infekcie vyvolané kmeňmi A. haemolyticum?
(Prípad je upravený podľa učebných materiálov Univerzity Sv. Juraja v Grenade.)
Vyvoláva infekcie dýchacích ciest (faryngitídy, tonzilitídy; ojedinele aj sínusitídy a pneumónie), infekcie kože a mäkkých tkanív (chronické kožné ulcerácie, abscesy, celulitídy a ranové infekcie) a zriedkavo sa izoluje aj od pacientov s osteomyelitídou, septickou artritídou, mozgovým abscesom, endokarditídou a sepsou. Faryngitídy vyvoláva najčastejšie u dospievajúcich a mladých dospelých vo veku 15 – 25 rokov (približne 3 % všetkých faryngitíd a tonzilitíd v tejto vekovej kategórii) a u starších ľudí. Invazívne infekcie sú typické pre starších a imunosuprimovaných pacientov (napr. s diabetom, neopláziami, alkoholizmom). Pri kožných infekciách sa Arcanobacterium haemolyticum pomerne často izoluje v zmesi s ostatnými kožnými grampozitívnymi patogénmi (beta-hemolytickými streptokokmi, S. aureus). Arcanobacterium haemolyticum je aj jedným z najčastejších sekundárnych kolonizátorov kožných lézií pacientov s leprou.
S beta-hemolytickými streptokokmi; odlíšiť sa dá mikroskopickým vyšetrením, reverzným CAMP-testom, negatívnymi typizačnými testami pre typizáciu beta-hemolytických streptokokov, biochemickými testami, MALDI-TOF MS, alebo metódami genómovej analýzy baktérií.
Ak sa krvný agar kultivuje iba 24 hodín, alebo sa nepátra po príznakoch slabej hemolýzy, ktorá v prítomnosti sprievodnej flóry nemusí byť veľmi výrazná.
Kmene A. haemolyticum sú obvykle dobre citlivé na penicilín a ostatné betalaktámové antibiotiká, makrolidové antibiotiká, linkozamidy, tetracyklíny a aminoglykozidy. Niekedy napriek výbornej in vitro citlivosti na penicilín dochádza ku klinickému zlyhávaniu liečby. Je to spôsobené schopnosťou arkanobaktérií invadovať do buniek hostiteľa a intracelulárne v nich perzistovať. Preto sa za liek prvej voľby pri liečbe faryngitíd obvykle považujú makrolidy, ktoré majú výborný intracelulárny prienik a penicilín G je skôr alternatívnou voľbou. Empirická liečba invazívnych infekcií sa opiera v prvom rade o vysoké dávky intravenózne podávaných betalaktámových antibiotík, pri závažnejšom stave aj v kombinácii s gentamicínom. Výhodou je v týchto prípadoch rýchle dosiahnutie účinných tkanivových koncentrácií a rýchly baktericídny efekt na metabolicky aktívne extracelulárne sa množiace baktérie (napr. v krvnom obehu pri sepse), čo má význam predovšetkým pri život ohrozujúcich stavoch. Pri neúplnej klinickej odpovedi a pretrvávajúcich pozitívnych výsledkoch mikrobiologického vyšetrenia napriek dobrej in vitro citlivosti na podávané betalaktámové liečivo je vhodné siahnuť k antibiotikám s dobrým intracelulárnym prienikom, akými sú makrolidy a linkozamidy (nevýhodou je ich primárne bakteriostatický efekt), alebo fluorochinolóny. Pri liečbe osteomyelitíd, endokarditíd a ďalších infekcií s pravdepodobnou účasťou biofilmu sa odporúča kombinovaná antimikrobiálna liečba, ktorá zahŕňa rifampicín. Chirurgická drenáž a debridment je indikovaný predovšetkým pri infekciách mäkkých tkanív a kostí; kardiochirurgický zákrok je potrebný v niektorých prípadoch infekcie endokardu.
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
9-ročné dieťa priniesli rodičia na pohotovosť pre zhoršenie stavu po 5-dňovej symptomatickej liečbe bolesti hrdla a kašľa. Pri prijatí dieťaťu pretrvávala zvýšená teplota, malo bilaterálne opuchnutý krk, problémy s prehĺtaním a dýchaním. Bol prítomný inspiračný stridor. Tonzily boli zapálené, krvácajúce, čiastočne pokryté bielym povlakom. Rodičia uviedli, že dieťa ochorelo po návrate z dovolenky v Thajsku, kde individuálne absolvovali aj niekoľkodňový výlet do odľahlej tradičnej thajskej dedinky. Na otázku, či dieťa doteraz absolvovalo všetky odporúčané očkovania, odpovedali záporne. Pretože dieťa sa začalo dusiť, bolo intubované a okamžite hospitalizované. Odobral sa aj výter tonzíl na mikroskopické a kultivačné vyšetrenie, ktoré preukázalo prítomnosť grampozitívnych nepravidelných paličiek. Kultivačne sa potvrdila prítomnosť kmeňa Corynebacterium diphtheriae. Výsledky ďalších testov preukázali výraznú leukocytózu (22 600 / mm3) s prevahou neutrofilov (74 %), tachykardiu, zvýšenú hladinu kreatinínu. Dodatočne sa vykonali ďalšie vyšetrenia, pričom sa zistili zmeny na EKG a zvýšené aktivity kardiomarkerov v sére (troponínu a kreatínkinázy). Dieťaťu sa podala príslušná kauzálna liečba a intenzívna starostlivosť.
Otázky ku kazuistike:
- Aká je diagnóza pacienta?
- Čo bolo pravdepodobným zdrojom infekcie a cestou prenosu?
- Ako často sa toto ochorenie vyskytuje na Slovensku?
- Je mikroskopické vyšetrenie výteru tonzíl rutinným vyšetrením?
- Aké ďalšie vyšetrenie je potrebné urobiť po izolácii kmeňa C. diphtheriae z klinickej vzorky?
- Aká je liečba diftérie?
- Aký má význam prítomnosť tachykardie, zmien na EKG a zvýšená aktivita kardiomarkerov?
- Aké preventívne opatrenia je nutné vykonať v súvislosti s výskytom diftérie?
- Opíšte spôsob špecifickej prevencie diftérie, ktorá sa vykonáva na Slovensku.
(Prípad je modelový)
Diftéria.
Dieťa sa pravdepodobne počas dovolenky stretlo s nosičom toxinogénneho kmeňa C. diphtheriae; baktéria sa na dieťa preniesla zrejme respiračnou cestou.
Vďaka vakcinácii proti diftérii sa toto ochorenia v súčasnosti na Slovensku vyskytuje veľmi zriedkavo.
Nie je; mikroskopické vyšetrenie výteru tonzíl má diagnostický význam iba pri podozrení na diftériu alebo Plaut-Vincentovu angínu.
Dôkaz produkcie difterického toxínu / dôkaz génu kódujúceho difterický toxín.
Podáva sa difterické antisérum obsahujúce protilátky, ktoré neutralizujú difterický toxín. Antibiotiká eradikujú C. diphtheriae, čím zastavujú ďalšiu produkciu toxínu v pacientovom organizme. Medzi účinné antibiotiká patrí penicilín, erytromycín, alebo klindamycín (pacientovi sa podávali vysoké dávky penicilínu-G intravenózne). K podpornej liečbe patrí udržiavanie priechodných dýchacích ciest, čo sa dosahuje antiedematóznou liečbou a v prípade potreby intubáciou alebo tracheotómiou (pacient bol intubovaný a podávala sa mu antiedematózna liečba). Pokoj na lôžku.
Môže to signalizovať poškodenie myokardu difterickým toxínom., ktorý sa môže vstrebávať z infikovanej sliznice do krvi a následne poškodiť aj vzdialené vnímavé bunky (napr. bunky myokardu).
Osobám v blízkom kontakte s chorým je potrebné vyšetriť výtery z nazofaryngu a v indikovaných prípadoch profylakticky podať antibiotiká a upomínaciu dávku antidifterickej vakcíny. Izolácia pacienta s diftériou je nešpecifickým opatrením proti ďalšiemu šíreniu infekcie.
Na Slovensku sa vykonáva celoplošná vakcinácia detí vakcínou obsahujúcou difterický toxoid. Základné očkovanie pozostáva z troch dávok vakcíny a podáva sa spoločne s ďalšími inaktivovanými vakcínami zahrnutými vo vakcinačnej schéme v prvom roku života. Deti sú preočkované v 5. a 12. roku života. Ďalšie preočkovanie sa uskutočňuje v 30. roku života a potom každých 15 rokov, spoločne s preočkovaním proti tetanu.
Autor: Liptáková A.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
20-ročná študentka medicíny bola prijatá v noci na jednotku intenzívnej starostlivosti s týmito príznakmi: vysoká horúčka trvajúca od ranných hodín, zimnica a erytematózna makulopapulárna vyrážka na rukách, nohách a na hrudníku. Vstupné biochemické testy preukázali zvýšené leukocyty a zvýšenú sedimentáciu. Bola odobratá krv na hemokultiváciu a do 10 hodín bol hlásený pozitívny mikroskopický nález gramnegatívnych diplokokov.
Otázky ku kazuistike:
1. Aké sú najčastejšie bakteriálne patogény spôsobujúce meningitídu?
2. Aké sú charakteristické zmeny v likvore pri podozrení na meningitídu?
3. Aký je štandardný diagnostický a liečebný postup pri podozrení na meningokokovú meningitídu?
N.meningitidis, H.influenzae, S. pneumoniae, L.monocytogenes, M.tuberculosis a u novorodencov: E.coli, hemolytické streptokoky skupiny B
| Bunky/ml | Bielkoviny (mg/dL) | Glukóza (mg/dL) | Pôvodcovia |
Normálne | 0-5 | 15-45 | 45-85 |
|
Septická (purulentná) meningitída | 200-200 000 (najmä neutrofily) | Vysoké hladiny (>100) | <45 | Baktérie, améby, mozgový absces |
Aseptická* meningitída alebo meningoencefalitída | 100-1 000 (najmä mononukleáry) | Stredne vysoké (50-100) | Normálne** | Vírusy, tuberkulóza, leptospira, huby, mozgový absces, čiastočne liečená bakteriálna meningitída |
* Aseptická, pretože je likvor sterilný pri bežnej bakteriologickej kultivácii
** Nízka (<45) pri tuberkulóze, leptospiróze a mykotických infekciách
Odber likvoru na potvrdenie diagnózy a okamžitá antibiotická liečba cefotaximom alebo ceftriaxonom. Blízkym kontaktom sa podáva profylakticky jednorázovo ciprofloxacín.
Autor: Horniačková M.
Pracovisko: Oddelenie mikrobiológie Lekárskej fakulty Slovenskej zdravotníckej univerzity, Bratislava
Kazuistika
Mladý, doteraz zdravý muž bol odoslaný na infekčné oddelenie 24 hodín po návrate z mesačného pobytu v Ázii (India) pre horúčky do 39,6 °C, únavu, malátnosť a bolesť hlavy. Pri horúčke mal opakovane zimnicu a triašku. Nauzeu ani zvracanie neudával, stolica bola jedenkrát denne, kašovitá. Prejavy gastroenteritídy a hnačky v klinickom obraze nedominovali. U pacienta boli prítomné pozitívne zápalové ukazovatele (zvýšené CRP, FW), ostatné vyšetrenia (laboratórne, zobrazovacie) boli bez patologických nálezov. Na mikrobiologické vyšetrenie boli odobraté viaceré biologické materiály – pri prijatí tri sady hemokultúr, tenký náter a hrubá kvapka na diagnostiku malárie, postupne opakovane stolica a výter z konečníka, moč na kultivačné vyšetrenie. Hemokultivačné vyšetrenie viedlo k záchytu Salmonella Parathyphi A, podľa kvantitatívneho stanovenia citlivosti (MIC) bola zistená rezistencia voči ciprofloxacínu. Stav bol hodnotený ako paratýfus typu A s ťažkým tyfóznym priebehom. Pacient bol úspešne liečený ceftriaxonom.
Ostatné vyšetrenia, ako aj opakované mikrobiologické vyšetrenia výteru z rekta boli negatívne (nedošlo ku vzniku bacilonosičstva).
Otázky ku kazuistike:
1. Čo bolo predpokladaným prameňom nákazy pacienta?
2. Aké metódy laboratórnej diagnostiky sa používajú na záchyt a identifikáciu salmonel?
3. Aké sú najčastejšie ochorenia spôsobené salmonelami?
Predpokladaným prameňom nákazy pacienta bolo požitie kontaminovanej vody alebo potravín pri jeho pobyte v cudzine.
Na záchyt a identifikáciu netýfusových salmonel vyvolávajúcich salmonelózy sa používajú metódy priamej mikrobiologickej laboratórnej diagnostiky. Biologický materiál sa odoberá podľa charakteru a lokalizácie ochorenia (gastroenteritída, extraintestinálne infekcie). V prípade gastroenteritíd je to výter z rekta, resp. stolica. Prítomnosť salmonel sa dokazuje kultivačným vyšetrením na selektívno-diagnostických médiách, druhovou identifikáciou a určením príslušného sérotypu sérotypizáciou (metódou sklíčkovej aglutinácie). V prípade podozrenia na brušný týfus a paratýfus sa používajú metódy priamej diagnostiky na záchyt a identifikáciu patogéna. Spektrum biologických materiálov zahŕňa krv na hemokultiváciu, stolicu, moč, žlč, prípadne kostnú dreň. Na začiatku ochorenia (v prvom týždni) je možné dokázať prítomnosť patogéna v krvi hemokultiváciou, záchyt zo stolice môže byť pozitívny až od druhého týždňa ochorenia. Sérologická metóda nepriamej diagnostiky – Widalova reakcia sa používa na detekciu tvorby a vzostupu protilátok proti somatickým a bičíkovým antigénom a Vi antigénu puzdra.
Najčastejšie ochorenia spôsobené salmonelami sú gastroenteritídy vyvolané netýfusovými salmonelami (S. Enteritidis, S. Typhimurium a iné).
Autor: Horniačková M.
Pracovisko: Oddelenie mikrobiológie Lekárskej fakulty Slovenskej zdravotníckej univerzity, Bratislava
Kazuistika
Marejková a kol. (Marejková M, Špačková M, Jágrová Z a kol.: Riziko pro občany EU/EEA spojené s výskytem cholery na Africkém rohu (Somálský poloostrov) a v Adenském zálivu – importovaný případ cholery do ČR. Zprávy CEM (SZÚ, Praha) 26 (4): 147–150, 2017) opísali prípad mladej ženy, ktorá sa vrátila do domovskej krajiny v Európe po pracovnom pobyte v oblasti Afriky. Ešte pred návratom mala bolesti brucha, chrbta a hnačku charakteru ryžového odvaru. Po symptomatickej samoliečbe došlo k zmierneniu príznakov, ktoré ale po návrate do vlasti pretrvávali a preto vyhľadala lekársku pohotovosť. Uviedla konzumáciu sushi s tuniakom, ktorého kúpili od miestneho rybára a opláchli vo vode zo studne, konzumáciu jedál v miestnej reštaurácii a tiež to, že prichádza z oblasti s výskytom cholery. Hospitalizovaná bola na infekčnom oddelení. Mikrobiologické kultivačné vyšetrenie stolice viedlo k izolácii kmeňa podozrivého na Vibrio cholerae, ktorý bol zaslaný do príslušného referenčného laboratória. Referenčné laboratórium identifikovalo kmeň ako V. cholerae O1, sérotyp Ogawa a metódou reverznej pasívnej latexovej aglutinácie potvrdilo tvorbu cholerového toxínu. Jednalo sa o potvrdený importovaný prípad cholery a prípad bol hlásený príslušnej hygienickej stanici. Pacientke bola podaná jednorázová dávka antibiotika (Doxycyklín 300 mg) a po krátkej hospitalizácii bolo možné prepustenie z nemocnice s nariadenou domácou karanténou. Nariadené a vykonané boli rozsiahle hygienicko-epidemiologické opatrenia (ohnisková dezinfekcia v mieste bydliska pacientky, sledovanie kontaktov pacientky vrátane kontaktov leteckých spoločností pri ceste letecky do vlasti – pasažieri, letecký personál a pracovných kontaktov v mieste pobytu v Afrike) s doporučením očkovania pre tam pracujúcich zamestnancov a zabezpečení a dezinfekcie tamojších studní.
Otázky ku kazuistike:
1. Čo bolo prameňom nákazy u pacientky?
2. Je v danom prípade indikované mikrobiologické kultivačné vyšetrenie na prítomnosť gastrointestinálnych patogénov ? Je potrebné informovať laboratórium o suspektnej možnosti výskytu cholery ? Ak áno, prečo ?
3. Je možné v tomto prípade použiť iba bežné mikrobiologické laboratórne postupy na kultiváciu črevných patogénov používané v našich podmienkach ?
4. Čo je dôležitým faktorom virulencie u V. cholerae O1 ?
5. Predstavuje V. cholerae O1 jediné agens, schopné vyvolať choleru s epidemickým výskytom ?
Prameňom nákazy u pacientky bolo kontaminované jedlo (tuniak opláchnutý vo vode z miestnej studne).
Mikrobiologické kultivačné vyšetrenie je dôležité na zistenie možného pôvodcu ochorenia. V tomto prípade viedlo k izolácii a potvrdeniu závažneho patogéna (V. cholerae O1, sérotyp Ogawa), pôvodcu importovaného prípadu cholery. O podozrení na ochorenia spôsobené vibriami je potrebné informovať príslušné laboratórium, aby boli použité vhodné laboratórne metódy na ich záchyt a identifikáciu.
Bežné mikrobiologické laboratórne postupy na kultiváciu črevných patogénov používané v našich podmienkach nie sú zamerané na izoláciu vibrií, ktoré sa u nás ako príčina ochorenia vyskytujú zriedkavo.Vibrio cholerae a iné vibriá vyžadujú odlišné postupy kultivácie biologického materiálu ako väčšina ostatných črevných patogénov (Campylobacter, Salmonella, a i.). Na záchyt vibrií je vhodné pomnožovancie médium (alkalická peptónová voda) a na kultiváciu selektívno-diagnostická pôda TCŽS. Definitívne potvrdenie identifikácie, sérotypizácia Vibrio cholerae a detekcia tvorby cholerového toxínu sa vykonáva v referenčných centrách (v SR Národné referenčné centrum pre Vibrionaceae). Cholera patrí medzi povinne hlásené prenosné ochorenia.
Dôležité faktory virulencie epidemických kmeňov V. cholerae O1 sú cholerový toxín a toxín koregulujúci pilus.
Choleru s edpidemickým výskytom môže vyvolať aj kmeň V. cholerae O139, tvorí rovnaké faktory virulencie ako V. cholerae O1.
Autor: Nováková E.
Pracovisko: Ústav mikrobiológie a imunológie Jeseniovej lekárskej fakulty v Martine Univerzity Komenského v Bratislave
Kazuistika
Autori Matzumura-Kuan a Jenning Matzumura-Kuan M. a Jennings J: Aggregatibacter actinomycetemcomitans infection mimicking lung cancer: A case report. Scand J Infect Dis 46 (9): 669-672, 2014) prezentujú prípad koinfekcie baktériou Aggregatibacter actinomycetemcomitans a Actinomyces spp., ktorá sa na rtg zobrazila ako mediastinálna hmota s klinickými príznakmi a chirurgickým nálezom imitujúcim malignitu. Predoperačné laboratórne vyšetrenia ani klinická symptomatológia neukazovali na bakteriálnu infekciu. Bioptické vyšetrenie a kultivácia peroperačne získaného tkaniva ukázala na infekčnú etiológiu. Predĺžená cielená kultivácia napokon potvrdila nález A. actinomycetemcomitans a Actinomyces spp. Po podaní antibiotík zobrazovacie metódy zaznamenali vymiznutie hmoty a postupne došlo k úprave klinického obrazu.
Otázky ku kazuistike:
1. Aké infekcie vyvoláva Aggregatibacter actinomycetemcommintans?
2. A. actinomycetemcommitans je súčasťou skupiny HACEK. S akými infekčnými chorobami súvisia mikroorganizmy tejto skupiny?
3. Vymenujte rodové názvy jej členov.
4. Aké sú spoločné charakteristiky týchto baktérií?
5. Akým spôsobom účinkuje na znižovanie imunity baktéria A. actinomycetemcommintans?
Infekcie periodontu a endokarditídu.
HACEK; periodontálne infekcie a subakútne endokarditídy.
Haemophilus, Aggregatibacter, Cardiobacterium, Eikenella a Kingella.
Sú súčasťou normálnej orofaryngeálnej mikrobioty, sú pomaly rastúce, obľubujú atmosféru s vyšším obsahom CO2 , majú schopnosť vyvolať subakútnu endokarditídu, sú gramnegatívne.
Produkciou leukotoxínu, proteázy rozkladajúcej molekuly IgG a produkciou cytotoxínu cdt.
Autor: Horniačková M.
Pracovisko: Oddelenie mikrobiológie Lekárskej fakulty Slovenskej zdravotníckej univerzity, Bratislava
Kazuistika
61 ročný pacient bol hospitalizovaný na OAIM pre polytraumu. Stav vyžadoval umelú pľúcnu ventiláciu. Na 7. deň hospitalizácie dochádza u pacienta k progresii pľúcneho infiltrátu, vzostupu telesnej teploty na 38,6°C, prítomná je leukocytóza 12,5.109/l a objavuje sa purulentný sekrét. Stav je hodnotený ako ventilátorová pneumónia (VAP). Na mikrobiologické vyšetrenie bol zaslaný tracheálny aspirát a tekutina z bronchoalveolárnej laváže (BAL).
V mikrobiologickom laboratóriu bola kultivačne potvrdená prítomnosť Acinetobacter baumannii, v tekutine z BAL kvantitatívnou kultiváciou v kvantite >104 /ml. Stanovená bola citlivosť na antimikrobiálne látky.
Otázky ku kazuistike:
1. Aké metódy je možné použiť na druhovú identifikáciu Acinetobacter spp.?
2. Opíšte mikroskopickú morfológiu Acinetobacter spp.
3. Je možné považovať izolovaného patogéna za príčinu VAP u pacienta ?
4. Akými metódami je vhodné stanoviť citlivosť na antimikrobiálne látky ?
Druhová identifikácia Acinetobacter spp. je problematická. Druhy Acinetobacter baumanii komplex (A. baumannii, A. pittii a A. nosocomialis) sa nedajú rozlíšiť konvenčnými fenotypovými testami. Určenie druhov je možné pomocou molekulárnych metód – sekvenovanie rpoB génu (gén pre β-podjednotku RNA polymerázy), gyrB génu (gén pre DNA gyrázu B) a MLSA (multilocus sequence analysis), ktoré však nie sú pre svoju náročnosť vhodné pre rutinnú mikrobiologickú laboratórnu diagnostiku. S rozvojom používania MALDI-TOF hmotnostnej spektrometrie je venovaná aj pozornosť rozvoju databáz vhodných na identifikáciu druhov Acinetobacter spp.
V mikroskopickom preparáte farbenom podľa Grama sa Acinetobacter spp. javí ako krátky zaoblený gramnegatívny kokobacil.
Acinetobacter baumannii môže byť príčinou infekcií dýchacích ciest (ventilátorová pneumónia) u hospitalizovaných pacientov, ako je to aj v uvedenom prípade. Patrí medzi závažné nozokomiálne patogény, ktoré sú schopné prežívať v nemocničnom prostredí a získavať a akumulovať rôzne mechanizmy rezistencie voči antimikrobiálnym látkam. Infekcie vyvolané rezistentnými kmeňmi sú preto závažným terapeutickým problémom.
Citlivosť na antimikrobiálne látky je možné stanoviť kvalitatívnymi a kvantitatívnymi in vitro metódami testovania. V prípade závažných infekcií je vhodné stanovenie minimálnej inhibičnej koncentrácie (MIC) kvantitatívnymi metódami, najčastejšie pomocou bujónovej mikrodilučnej metódy, v súlade s medzinárodnými odporúčaniami (EUCAST, CLSI).
Autor: Botek R.
Pracovisko: Laboratoria s.r.o., Piešśany
Kazuistika
Bowen a kol. (Bowen EE, Hangartner R, Macdougall I: Campylobacter-associated hemolytic uremic syndrome associated with pulmonary-renal syndrome. J Gen Intern Med 3 (31): 353–56, 2015) opísali prípad 22 ročnej ženy, ktorá bola prijatá do nemocnice so 6 dní trvajúcou vodnatou hnačkou bez prímesi krvi a bolesťami hlavy vo frontálnej oblasti. 24 hodín pred príznakmi jedla kebab. V predchorobí neudávala zdravotné ťažkosti až na ovariálnu polycystózu s miernou endometriózou. Lieky neužívala s výnimkou antikoncepcie (co-cyprindiol) a sporadicky diklofenak pre bolesti hlavy. Nefajčiarka, abúzus drog popierala. Bez cestovateľskej anamnézy. Pracovala ako kozmetička. Krvný tlak 105/58 mmHg, pulz 98, bledá pokožka s ortostatickou hypotenziou akcelerovanou srdcovou akciou a oligoúriou (315 ml moču/24 hodín), bez distálnych edémov a zvýšeným jugulárnym venóznym tlakom. Koža čistá bez eflorescencií a rašu. V laboratórnom náleze anémia, trombocytopénia a akútne zlyhávanie obličiek s acidózou bez prítomnosti anti GMB (bazálna membrána glomerulov), ANCA (anti cytoplazma neutrofilov) a ANA. Napriek neprítomnosti krvi v stolici bol stav po izolácii Campylobacter jejuni izolovanom zo stolice diagnosticky uzavretý ako hemolyticko-uremický syndróm pri diarhoeae spôsobenej Campylobacter jejuni. V terapii sa podala intravenózna saturácia tekutinami s natrium bikarbonátom a v dôsledku nastúpeného periférneho edému dialýza. Po 10 dňoch sa pacientkin stav zlepšil a dialýza bola prerušená. U pacientky sa však po štyroch dňoch rozvinula pulmonálna hemorágia ako imunologická reakcia na kampylobakterovú infekciu. Tento stav bol ad integrum zvládnutý intravenóznym pulzom metylprednizonu a následne 500,0 mg perorálne. Konzílium sa ustálilo na diagnóze hemolyticko-uremický syndróm (HUS) asociovaný s Campylobacter jejuni a pulmonálno renálnym syndrómom.
Otázky ku kazuistike:
1. Prečo by ste u pacienta s HUS vyšetrovali stolicu kultivačne, alebo molekulárne?
2. Čo je dominantná známka enterokolitídy vyvolanej Campylobacter jejuni/coli?
3.Aké iné extraintestinálne komplikácie spôsobuje infekcia Campylobacter jejuni?
4. Aké sú podmienky odberu a transportu biologického materiálu na izoláciu kampylobakterov?
5. Kedy možno očakávať predbežný výsledok kultivácie kampylobakterov?
6. Ktoré antibiotikum by ste použili v liečbe závažnej kampylobakterovej enteritídy u detí?
HUS je najčastejšie spájaný s Escherichia coli skupiny EHEC a Campylobacter jejuni/coli.
Prímes krvi v stolici v dôsledku poškodenia sliznice.
Guillainov-Barrého syndrómu a Millerov-Fisherov syndróm.
Odber do transportného média, pretože kampylobaktery sú citlivé na vyschnutie a expozíciu O2..
48 až 72 hodín
Makrolidy – azitromycín alebo klaritromycín
Kazuistika
Kim a Dorshimer (Kim PK, Dorshimer GV: Case Report: peptic ulcer disease in a professional athlete. Phys Sportsmed 37 (2): 136-140, 2009) opísali prípad 24-ročného profesionálnneho futbalistu, ktorý navštívil praktického lekára pre 2 až 3 týždne trvajúce bolesti v epigastriu, spočiatku 1 až 2 hodiny po jedle. Bolesť opisoval ako „pálenie na hrudníku, vyžarujúce spod sterna strácajúce sa v priebehu niekoľkých hodín“. Neudával námahovú bolesť, dyspnoe, závrate, palpitácie, melénu, malátnosť, ani nadmerný stres. Z liekov užíval len nepravidelne perorálny diklofenak niekoľko mesiacov pre bolesti kĺbov. V predchorobí len hemoroidy, v rodinnej anamnéze neudával gastrointestinálne ochorenia. Pri návšteve bol nasadený inhibítor protónovej pumpy (esomeprazol 40 mg 2x denne). Bola naplánovaná gastrofibroskopia, ktorá odhalila mnohopočetné drsné erytematózne ložiská steny žalúdka a nekrvácajúci duodenálny vred. Biopsia steny žalúdka ukázala aktívnu chronickú gastritídu s nálezom Helicobacter pylori. Liečba bola doplnená o amoxicilín/klavulanát 875/125 mg 2x denne a klaritromycín 500mg 2x denne počas 14 dní. Liečba esomeprazolom pokračovala do troch mesiacov. Stav sa upravil po dobratí antibiotík.
Otázky ku kazuistike:
1. Aká je úloha ureázy v prežívaní H. pylori na sliznici žalúdka a v patogenéze gastritídy?
2. Ktoré sú najdôležitejšie faktory virulencie H. pylori?
3. Aké metódy detekcie H. pylori sú v súčasnosti používané?
4. Ktoré antibiotiká sa používajú v liečbe helikobakterovej infekcie?
Tvorbou amoniaku zvyšuje pH žalúdočnej šťavy
Pohyb, adherencia, produkcia toxínov VacA, CagA
Kultivácia, mikroskopia, dôkaz antigénu v stolici a ureázový dychový test
Amoxicilín, klaritromycín, metronidazol
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
Autori Melo a kol. (Melo N, Dias AC, Isidoro L, Duarte R: Bordetella pertussis, an agent not to forget: a case report. Cases Journal 2:128, 2009) opísali prípad 11-ročného dieťaťa hospitalizovaného z diagnostických dôvodov pre 4 týždne trvajúci kašeľ s nočnými paroxyzmálnymi záchvatmi a občasnou hlasitou inspiráciou. Dieťa bolo anorektické a počas 4 týždňov trvania kašľa schudlo 1,5 kg. Okrem kašľa neboli prítomné iné príznaky infekcie dýchacích ciest (bez bolesti hrdla, bez nádchy) alebo zápalu (bez teploty, bez zimnice, bez myalgie). Týždeň pred hospitalizáciou mu detský lekár prvého kontaktu naordinoval amoxicilín, antihistaminikum a brochodilatačnú terapiu, ktoré však nepriniesli žiadne zlepšenie; záchvaty kašľa sa naďalej stupňovali, občas končili hlasitou híkavou inspiráciou a emézou. Dieťa absolvovalo všetky vakcinácie zahrnuté vo vakcinačnom programe (vrátane pertussis), preto vzhľadom na klinické príznaky a epidemiologickú situáciu v oblasti, z ktorej pochádzalo (stúpajúci výskyt tuberkulózy), jeho ošetrujúci lekár žiadal vylúčiť možnosť tuberkulózy. Pri príjme malo dieťa telesnú teplotu 37 °C, 96 % saturáciu kyslíkom a časté záchvaty kašľa. Sliznica faryngu bola mierne nastrieknutá, bez exsudátov. Uzliny neboli zväčšené. Pri auskultácii pľúc sa pozorovali difúzne praskoty a pískanie pri expirácii. Rozbor krvi preukázal zvýšený počet leukocytov s lymfocytózu. Hodnoty CRP neboli zvýšené. Rtg vyšetrenie hrudníka ukázalo zosilnenú perihilárnu bronchovaskulárnu kresbu a heterogénne infiltráty inferiórnych tretín oboch pľúc. Tuberkulínový test bol negatívny. Na cielený dôkaz mikrobiálnej DNA M. tuberculosis, ale aj B. pertussis, sa odobrala vzorka obsahu žalúdka, pretože odber spúta nebol úspešný. PCR analýza vzorky dokázala prítomnsť DNA B. pertussis. Dieťaťu sa indikovalo podávanie klaritromycínu v trvaní 14 dní. Všetkým ľuďom v blízkom kontakte sa odporučilo profylaktické užívanie klaritromycínu. U dvoch členov rodiny dieťaťa sa prejavili klinické príznaky pertussis a podrobili sa náležitej liečbe.
Otázky ku kazuistike:
1. Čím si vysvetľujete stratu na váhe dieťaťa?
2. V ktorom štádiu pertussis bolo dieťa hospitalizované? Aké ďalšie štádiá má pertussis?
3. Prečo bola prítomná lymfocytóza a neboli zvýšené hladiny CRP? Je tento nález typický pre pertussis?
4. Bol odber materiálu a požiadavka na mikrobiologické vyšetrenie z hľadiska suspektnej pertussis zvolené správne a optimálne?
5. Bola by v tomto štádiu šanca na úspešný kultivačný dôkaz pôvodcu čierneho kašľa?
6. Aké ďalšie vyšetrenie by sa mohlo urobiť, ak by PCR analýza nebola úspešná?
7. Prečo nebola empirická liečba ampicilínom úspešná?
8. Prečo dostalo dieťa pertussis aj napriek tomu, že absolvovalo základnú sériu očkovania?
9. Malo odporúčanie profylaktického podávania antibiotík osobám v blízkom okolí dieťaťa racionálny základ?
4 týždne trvajúcim vysiľujúcim kašľom s emézami.
Vo 4. týždni paroxyzmálneho štádia. Po 7-10 dňovom inkubačnom čase vzniká katarálne štádium, ktoré je po 1-2 týždňoch vystriedané paroxyzmálnym štádiom a po 1-6 týždňoch paroxyzmálneho kašľa prichádza štádium rekonvalescencie.
Pertusový toxín inhibuje migráciu lymfocytov do lymfoidných orgánov, čo sa prejaví lymfocytózu v krvnom obraze počas paroxyzmálneho štádia. Toto štádium pertussis nie je charakteristické zápalovou aktivitou a hladiny CRP, na rozdiel od bakteriálnych zápalových ochorení, nebývajú výrazne zvýšené.
Optimálne to nebolo, ale napriek tomu sa pri diagnostike urobilo všetko, čo bolo možné vykonať (a s úspešným záverom). Vhodným materiálom by bol výter alebo aspirát sekrétu nosohltana; mohlo by sa odobrať aj spútum. V prípade, ak pacient nevykašliava spútum, môže sa odobrať bronchoalveolárna laváž. Keďže šlo o dieťa a navyše sa pátralo predovšetkým po pôvodcovi TBC, ako alternatívny materiál sa zvolil aspirát obsahu žalúdka. V tomto materiáli je prítomné aj spútum, ktoré deti skôr prehĺtajú než vykašliavajú. Ďalšou všeobecnou zásadou je, že materiál na dôkaz nukleovej kyseliny B. pertussis by sa mal odobrať najneskôr do 4. týždňa po nástupe paroxyzmálneho kašľa, pretože úspešnosť dôkazu sa znižuje s dĺžkou intervalu od nástupu typického kašľa po odber materiálu. Napriek viacerým neštandardným okolnostiam odberu materiálu z hľadiska diagnostiky pertussis bol dôkaz DNA B. pertussis úspešný.
Táto šanca je vo 4. týždni paroxyzmálneho štádia pertussis veľmi malá, blížiaca sa k nule.
Ďalšou možnosťou je v tomto štádiu dôkaz špecifických protilátok proti pertusovému toxínu v sére pacienta.
Pôvodca pertussis nie je citlivý na penicilínové ani na cefalosporínové antibiotiká. Liekom voľby sú makrolidové antibiotiká, alternatívnou voľbou je kotrimoxazol. Okrem toho, antibiotiká podané v štádiu paroxyzmálneho kašľa už veľmi neovplyvnia klinické príznaky, ale skrátia vylučovanie baktérií z respiračného traktu chorého.
Postvakcinačná imunita začína približne po 5 rokoch od vakcinácie klesať. Z opisu prípadu nie je jasné, či a kedy sa dieťaťu podala upomínacia dávka vakcíny. Na nedostatočnej ochrane pred pertussis sa mohla podieľať aj nižšia imunogénnosť subcelulárnej vakcíny v porovnaní s celobaktériovou, alebo nové genetické varianty kmeňov B. pertussis kolujúce v oblasti, z ktorej dieťa pochádzalo.
Áno, pretože pertussis je vysoko nákazlivé infekčné ochorenie a jeho pôvodcu šíria infikovaní ľudia alebo bacilonosiči respiračnými sekrétmi kvapôčkovou infekciou. V prípade nevakcinovaných ľudí v úzkom kontakte s chorým je vhodné monitorovanie v trvaní 3 týždňov po poslednom kontakte a podľa veku, rizík a stavu imunity aj profylaxia antibiotikami (napr. azitromycínom).
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
Autori Kümpers a kol. (Kümpers P, Tiede A, Kirschner P: Legionnaires’ disease in immunocompromised patients: a case report of Legionella longbeachae pneumonia and review of the literature. J Med Microbiol 57: 384–387, 2008) opísali prípad 69-ročného muža, ktorý prišiel na pohotovosť pre problémy s dýchaním pri námahe, neproduktívny suchý kašeľ a horúčku. Bol malátny a sťažoval sa aj na nočné potenie. V anamnéze chronická idiopatická trombocytopenická purpura s epizódami relapsov aj napriek splenektómii pred 4 rokmi. Posledný relaps pred 3 týždňami, trojdňová liečba dexametazónom (syntetický glukokortikoid). Pacient mal pri príjme teplotu 39,4 ºC, pulz 117/min., respiračnú frekvenciu 26/min a tlak 115/72 mmHg. Fyzikálne vyšetrenie preukázalo tlmený poklop nad pravým stredným pľúcnym poľom a jemný krepitus pri auskultácii. V laboratórnych testoch leukocytóza (13,4/nl), trombocytopénia (3/nl), zvýšené hladiny CRP (392 mg/l), mierna hypoxia a respiračná alkalóza vyvolaná hyperventiláciou. RTG snímka a CT preukázali konfluentnú infiltráciu v pravom strednom pľúcnom laloku. Od pacienta sa odobrala bronchoalveolárna laváž na mikroskopické vyšetrenie, PCR analýzu, kultivačné a virologické vyšetrenie. Okrem toho sa odobral aj moč na dôkaz legionelového antigénu a krv na hemokultiváciu. Empiricky sa mu začala podávať kombinácia piperacilínu s tazobaktamom, ale jeho stav sa naďalej zhoršoval. Mikroskopické vyšetrenie preparátov farbených podľa Grama a Ziehla-Neelsena bolo negatívne, podobne aj dôkaz legionelového antigénu v moči. PCR analýza 18 hodín po odbere materiálu dokázala prítomnosť DNA L. longbeachae v bronchoalveolárnej laváži. Tento nález potvrdilo o niekoľko dní aj kultivačné vyšetrenie – rast suspektných kolónií na BCYE agare, parciálnou sekvenáciou génu pre 16S rRNA identifikovaných ako L. longbeachae. Kultivácia na dôkaz ostatných pôvodcov pneumónie, mykobaktérií a virologické vyšetrenie boli negatívne. Hneď po oznámení detekcie legionelovej DNA vo vzorke BAL sa pacientova liečba zmenila na intravenózne podávaný moxifloxacín. Pacientov stav sa začal rapídne zlepšovať, podávanie moxifloxacínu sa zmenilo na perorálne a ukončilo sa po 12 dňoch po úplnom upravení klinického stavu.
Otázky ku kazuistike:
1. Dal sa z pacientových klinických príznakov a výsledkov ďalších vyšetrení jednoznačne definovať pôvodca infekcie?
2. Prečo mal test na dôkaz legionelového antigénu v moči negatívny výsledok?
3. Prečo bola negatívna hemokultúra?
4. Aké ďalšie mikrobiologické vyšetrenie by sa mohlo použiť na potvrdenie diagnózy legionárskej choroby?
5. Je výskyt druhu L. longbeachae u pacientov s legionelózou častý?
6. Prečo empirická liečba kombináciou piperacilínu s tazobaktamom neviedla k zlepšeniu stavu pacienta?
7. Aké predispozičné faktory pre vznik legionárskej choroby mal prezentovaný pacient?
8. Akým spôsobom sa pacient mohol nakaziť? Akými mikrobiologickými metódami by sa mohol predpokladaný zdroj infekcie potvrdiť?
Nie, legionelózy začínajú nešpecifickými prejavmi zápalového ochorenia a legionárska choroba sa prejavuje ako atypická pneumónia so systémovými prejavmi.
Test na dôkaz legionelového antigénu v moči využíva diagnostické protilátky reagujúce s antigénom L. pneumphila séroskupiny 1, ktorá vyvoláva približne 70% legionelóz. Test nedeteguje antigény iných druhov a séroskupín legionel, teda ani antigény L. longbeachae. Práve z tohto dôvodu je pri podozrení na legionelózu potrebné zaslať materiál aj na kultivačné vyšetrenie a dôkaz DNA baktérie, prípadne v neskoršom štádiu ochorenia sérum na dôkaz špecifických protilátok.
Citlivosť hemokultivácie pri legionárskej chorobe je len 10-30%. Pozitívnu hemokultúru mávajú obvykle pacienti s podstatne zníženou imunitou a závažným priebehom choroby.
Okrem dôkazu legionelového antigénu v moči, kultivácie a dôkazu DNA baktérie, aj dôkaz legionel vo vzorkách pomocou imunofluorescencie, ktorý sa však v súčasnosti už používa veľmi zriedkavo. Dôkaz protilátok proti legionelám má diagnostický význam až v neskorších fázach infekcie a väčšinou len retrospektívne potvrdzuje infekciu.
Nie je; izoluje sa obvykle od pacientov so zníženou imunitou.
Legionela nie je v organizme chorého citlivá na betalaktámové antibiotiká (intracelulárna lokalizácia). Liekom voľby sú makrolidové antibiotiká a fluorochinolóny.
Muž nad 45 rokov veku, imunosupresia (splenektómia, liečba glukokortikoidmi).
Inhaláciou infekčného aerosólu; v prípade L longbeachae aj manipuláciou s vlhkým kompostom a pôdou. Zdroj infekcie sa môže potvrdiť kultiváciou rovnakého kmeňa legionel z klinických vzoriek odobratých od pacienta a z predpokladaného zdroja. Typizácia legionel sa v súčasnosti uskutočňuje nielen sérologickými metódami, ale aj metódami molekulárnej typizácie.
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
Matka priviedla 9-ročné dievčatko k lekárovi pre niekoľko dní pretrvávajúce teploty, letargiu a bolesť hlavy. Pri vyšetrení sa zistila drobná pustula s mierne opuchnutým okolím na pravom ramene a unilaterálna pravostranná axilárna lymfadenopatia. Na otázku o pôvode pustuly sa dievčatko priznalo, že sa na dvore hrali s mačiatkami, ktoré priniesla von jej kamarátka a jedno z nich ju nechtiac poškriabalo. Poranené miesto sa nezahojilo, po niekoľkých dňoch opuchlo a neskôr sa objavil opuch a bolestivosť lymfatických uzlín v pravom podpazuší. Pri cielenom sérologickom vyšetrení sa zistila prítomnosť protilátok proti Bartonella henselae v triede IgM aj IgG.
Otázky ku kazuistike:
- Aká je diagnóza dievčatka?
- Čo bolo zdrojom infekcie a ako sa baktéria preniesla na dievčatko?
- Aké sú ďalšie možné cesty prenosu?
- Aké sú komplikácie tejto infekcie a u koho môžu vzniknúť?
- Aké sú diagnostické možnosti tohto ochorenia?
- Aká by mala byť liečba pacientky?
- Vyskytuje sa toto ochorenia aj na Slovensku?
(Prípad je modelový)
Choroba z mačacieho škrabnutia.
Zdrojom infekcie bolo mačiatko, ktoré malo baktériou kontaminované pazúriky. Pri poškriabaní ramena nastala inokulácia týchto baktérií priamo do rany.
Pohryznutie mačkou, alebo kontakt s fekáliami mačacej blchy.
Bacilárna pelióza, bacilárna angiomatóza, chronická bakteriémia, subakútna endokarditída; najčastejšie vznikajú u oslabených ľudí.
Obvykle sa podarí klinickú diagnózu potvrdiť dôkazom protilátok, ale je možné pokúsiť sa aj o detekciu špecifickej nukleovej kyseliny pôvodcu v biopsii z postihnutej lymfatickej uzliny.
Vo väčšine prípadov dôjde k uzdravenie spontánne aj bez antibiotík. Ak hrozí riziko vzniku komplikácií a diseminácie, môžu sa podať makrolidy (napr. azitromycín), alebo tetracyklíny (napr. doxycyklín). Penicilíny, cefalosporíny prvej generácie a klindamycín na bartonely v organizme pacienta neúčinkujú.
Výskyt choroby z mačacieho škrabnutia je celosvetový.
Autor: Liptáková A.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
80-ročná starenka z dedinky na východe Slovenska navštívila lekára kvôli nehojacej sa rane na ruke. K úrazu došlo pri okopávaní záhonov pred dvoma dňami. Lekár ošetril ranu a pre anamnestický údaj o absencii preočkovania proti tetanu (starenka bola očkovaná proti tetanu pred dvadsiatimi rokmi), postupoval podľa odporúčaní pri podozrení na infekciu Clostridium tetani.
Otázky ku kazuistike:
1. Aký je správny diagnostický a liečebný postup?
2. Aké komplikácie môžeme očakávať?
3. Aká je vaša predbežná diagnóza?
4. Aké sú pravdepodobné možnosti nákazy?
5. Aká je možná špecifická a nešpecifická prevencia tetanu?
6. Aké sú účinné protiepidemické opatrenia?
Okamžité chirurgické ošetrenie primárnej rany (ktorá môže vyzerať neškodná), aplikácia penicilínu alebo metronidazolu na usmrtenie baktérií a redukciu tvorby toxínu, pasívna imunizácia ľudským tetanovým imunoglobulínom a vakcinácia tetanovým toxoidom.
Bez profylaxie existuje potenciálna hrozba rozvoja generalizovanej formy tetanu, ktorá môže mať fatálny priebeh.
Celulitída, riziko tetanu
Kontaminácia rany pôdou obsahujúcou spóry C. tetani.
Nešpecifickou prevenciou je vyhnúť sa poraneniu kože a jej následnej kontaminácie pôdou, ktorá by mohla obsahovať spóry, správne ošetrenie rany, špecifickou prevenciou je pasívna imunizácia ľudským tetanovým imunoglobulínom a vakcinácia tetanovým toxoidom.
Základné očkovanie v detstve, kontrola očkovacieho kalendára pri pravidelných preventívnych prehliadkach u všeobecného lekára a včasné podávania upomínacích dávok tetanického toxoidu, (najmä u staršej populácie).
Autor: Liptáková A.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
Troch mužov – robotníkov zo stavby diaľnice pri Lučenci prijali s príznakmi suchosti v ústach, paralýzy, dýchacími ťažkosťami. Všetci spolu deň pred tým obedovali po domácky pripravené mäsové konzervy.
Otázky ku kazuistike:
1. Aká je vaša predbežná diagnóza?
2. Čo je etiologický agens danej infekcie?
3. Aký materiál odoberiete a akým spôsobom?
4. Aké sú potrebné laboratórne vyšetrenia?
5. Aké sú pravdepodobné možnosti nákazy?
6. Ako sa toto ochorenie môže liečiť?
7. Aká je možná špecifická a nešpecifická prevencia infekcií?
Potravinový botulizmus
Najpravdepodobnejšie Clostridium botulinum
Stolica, sérum, obsah žalúdka, suspektná potravina
Dôkaz toxínu v stolici, sére a kontaminovanej potravine pokusom na zvierati, imunochemickými metódami, alebo detekcia génu pre tvorbu toxínu
Nedostatočne tepelne spracované mäso, baktérie prešli do štádia sporulácie, spóry pri vhodnej zmene podmienok germinovali a vegetatívne formy začali produkovať toxíny do potravinovej konzervy.
Vykonáva sa pomocou trivalentného antiséra, ktoré obsahuje protilátky proti toxínu A, B a E. Protilátky inaktivujú toxíny, ktoré cirkulujú v krvi. Veľmi dôležitá je tiež podporná liečba, Pri ochrnutí dýchacích svalov musí byť pacient hospitalizovaný na jednotke intenzívnej starostlivosti a napojený na ventilátor, ktorý zabezpečuje umelú pľúcnu ventiláciu. Pretože botulotoxín spôsobuje aj ochrnutie svalstva žalúdočno-črevného traktu, je nevyhnutné odstrániť toxín tak zo žalúdka ako aj z čreva. Cieľom je zabrániť ďalšej resorpcii, čiže prijatiu jedu zo žalúdočno-črevného traktu do krvi. Toto je možné napr. výplachom žalúdka a podaním preháňadiel.
Ochoreniu sa dá predchádzať zničením spór v konzervovaných potravinách správnym výrobným postupom, zabránením germinácie spór (v kyslom pH, alebo uchovaním potravín pri teplote 4 °C a nižšej) alebo zničením preformovaného toxínu (všetky botulotoxíny sú inaktivované teplom od 60 °C do 100 °C za 10 minút).
Autor: Liptáková A.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
23-ročný homosexuálne orientovaný muž navštívil infekčnú kliniku pre nebolestivý vred na penise. Pre podozrenie na primárny syfilis mu bola odobratá krv na sérologické vyšetrenie (na dôkaz protilátok). Testy potvrdili diagnózu syfilis.
Otázky ku kazuistike:
1. Prečo u mnohých pacientov so syfilisom prejde akútna fáza do chronického štádia?
2. Aké testy potvrdzujú klinické podozrenie na syfilis?
Dôkaz protilátok |
Špecifické FTA-ABS (fluorescent treponemal antibody absorbtion test) TP-PA (T.pallidum particle agglutination test) TPHA (T.pallidum haemagglutination test) |
Avšak je nutné myslieť aj na prípady falošnej pozitivity.
Autor: Blažeková M.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
15-ročné dievča s negatívnou osobnou anamnézou bolo prijaté pre progredujúci bolestivý opuch pier a tvorbu áft znemožňujúci perorálny príjem. Pred hospitalizáciou sa už dva týždne liečila symptomaticky pre bronchitídu s vlhkým kašľom, v úvode s febrilitami do 40 °C. Pre pretrvávajúci kašeľ bola u pacientky 5 dní pred hospitalizáciou ordinovaná liečba klaritromycínom. Objektívne pacientka mala pri prijatí bilaterálnu purulentnú konjunktivitídu, edematózne popraskané pery, rozsiahle afty na bukálnej sliznici a na spodnej strane jazyka. Auskultačne vľavo bazálne jemný krepitus, CRP 13 mg/L, sedimentácia 48/96, mierna leukocytóza. RTG snímka bez ložiskových zmien s výraznejšou bronchovaskulárnou kresbou bilaterálne. Sérologické vyšetrenia ukázali vysoké hodnoty protilátok triedy IgM a IgG proti M. pneumoniae. Diagnóza uzavretá ako akútna infekcia M. pneumoniae s extrapulmonálou manifestáciou.
Otázky ku kazuistike:
1. Ako môžeme diagnostikovať akútne mykoplazmové ochorenie ?
2. Čo je unikátne na stavbe bunky mykoplaziem a aký to má význam pre antibiotickú liečbu ?
Infekciu vyvolanú M. pneumoniae najčastejšie diagnostikujeme nepriamo identifikáciou protilátok typu IgM a IgG, u starších ľudí aj IgA. Vo vybraných laboratóriách je možná aj priama diagnostika pomocou PCR.
Bunka mykoplaziem je unikátna tým, že nemá rigidnú bunkovú stenu ale na svojom povrchu má trojvrstvovú cytoplazmatickú membránu. Z toho dôvodu na mykoplazmy neúčinkujú betalaktámové antibiotiká ani ďalšie antibiotiká, ktoré interferujú so syntézou bunkovej steny.
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
67-ročný pacient vyhľadal lekársku pomoc dva dni po odstránení kliešťa vo vlasatej časti hlavy, kedy sa u neho objavilo začervenanie kože s ulceráciou v mieste prisatia kliešťa a bolestivé zdurenie lokálnych lymfatických uzlín. Pacient mal horúčku (40 °C), bol malátny a sťažoval sa na bolesť hlavy. Neudával kontakt so zvieratami a negatívna bola aj jeho cestovateľská anamnéza. Pacient mal miernu leukocytózu a zvýšenú hladinu CRP. Hemokultúry boli negatívne, ster z kožnej lézie poskytol len rast bežnej kožnej flóry. CT vyšetrenie preukázalo edematózne zmeny tkaniva pod kožnou léziou a lokálnu lymfadenitídu bez nekrózy a tvorby abscesu. Sérum pacienta sa vyšetrilo na dôkaz protilátok proti Francisella tularensis, Borrelia burgdorferi, Rickettsia prowazekii, a Rickettsia typhi, s negatívnym výsledkom. Pacientovi sa empiricky podal ampicilín so sulbaktamom v kombinácii s ciprofloxacínom. Po trojdňovej liečbe sa jeho stav začal zlepšovať. Následné cielené vyšetrenie pôvodnej vzorky séra a ďalších vzoriek odobratých o 7 a o 14 dní na prítomnosť protilátok proti kliešťom prenosným riketsiám preukázalo sérokonverziu v triedach IgM aj IgG proti R. slovaca, R. conorii a R. helvetica. Vyšetrenie kliešťa PCR testom dokázalo prítomnosť nukleovej kyseliny Rickettsia slovaca. Pacient sa uzdravil bez ďalších komplikácií napriek tomu, že sa mu nepodávala špecificky cielená antiriketsiová terapia.
(Podľa Rieg S, Schmoldt S, Theilacker C a kol.: Tick-borne lymphadenopathy (TIBOLA) acquired in Southwestern Germany. BMC Infect Dis 11:e167, 2011.)
Otázky ku kazuistike:
1. Ako by ste definovali diagnózu pacienta na základe klinických príznakov?
2. Ako by ste definovali diagnózu pacienta po oboznámení sa z výsledkami mikrobiologických laboratórnych testov?
3. Ktorá baktéria bola najpravdepodobnejšie príčinou pacientových zdravotných problémov a ako sa ňou pacient nakazil?
4. Ako by ste vysvetlili prítomnosť protilátok v sére pacienta až proti trom druhom riketsií?
5. Čo je liekom voľby pri liečbe infekcie, ktorú mal pacient a prečo nebolo nutné meniť antibiotickú liečbu pacienta?
Horúčka neznámeho pôvodu s lymfadenitídou; pravdepodobný prenos kliešťom.
TIBOLA
Rickettsia slovaca - jej DNA bola prítomná v tele kliešťa a protilátky proti nej sa dokázali aj v sére pacienta. Baktériu na pacienta preniesol kliešť.
Mohlo ísť o koinfekciu (v tomto prípade málo pravdepodobné), infekciu druhmi R. conorii a R. helvetica v minulosti (tiež málo pravdepodobné), alebo o skríženú sérologickú reaktivitu medzi týmito troma druhmi riketsií (najpravdepodobnejšie).
Liekom voľby je tetracyklín. Pacientov stav sa zlepšil aj napriek empirickej terapii založenej na podávaní ampicilínu so sulbaktamom v kombinácii ciprofloxacínom, pravdepodobne vďaka citlivosti pôvodcu na ciprofloxacín a vďaka účinnej imunitnej odpovedi pacienta.
Autor: Slobodníková L.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
38 ročná pacientka, ktorá bývala na dedine v blízkosti farmy s hovädzím dobytkom a kozami, bola hospitalizovaná s podozrením na chronickú endokarditídu. V čase hospitalizácie trvali jej ťažkosti už viac než 8 mesiacov. Prejavovali sa zvýšenou teplotou, nočným potením, únavou, stratou hmotnosti a záchvatovitým kašľom, ktorý pretrvával aj po viacerých empirických antibiotických kúrach. V detstve prekonala korekčnú operáciu srdca pre vrodenú srdcovú chybu. Kardiologické vyšetrenie preukázalo srdcový šelest a biochemické vyšetrenie krvi zvýšenú aktivitu pečeňových enzýmov. Odobrali sa jej hemokultúry, ktoré však ostali negatívne aj po predĺženej kultivácii. Na základe uvedených výsledkov odoslal ošetrujúci lekár do mikrobiologického laboratória sérum pacientky na vyšetrenie protilátok proti C. burnetii. Zistili sa vysoké titre protilátok proti C. burnetii fázy 1 aj 2 a začala sa antibiotická terapia pacientky.
Otázky ku kazuistike:
1. Ktoré baktérie prichádzajú do úvahy ako pôvodcovia subakútnej endokarditídy?
2. Čo by mohlo viesť lekára k podozreniu na subakútnu endokarditídu coxielovej etiológie a aké diagnostické testy by mohli potvrdiť jeho podozrenie?
3. Akým spôsobom sa mohla pacientka nakaziť?
4. Mala pacientka nejaké faktory predisponujúce pre coxielovú endokarditídu?
5. Akým spôsobom by sa pacientka mala liečiť a aká je prognóza?
Viridujúce streptokoky, enterokoky, skupina HACEK, coxiely; v prípade umelej chlopne aj koaguláza-negatívne stafylokoky, nepatogénne kožné korynebaktérie, alebo kutibaktérie (bývalé propionibaktérie).
Klinický priebeh, negatívna hemokultúra, anamnestické údaje. Podozrenie na coxielovú etiológiu potvrdí dôkaz špecifických protilátok alebo špecifickej bakteriálnej DNA. Pre chronickú formu Q-horúčky (teda aj pre endokarditídu) je typický vysoký, resp. stúpajúci titer sérových protilátok proti obom fázam C. burnetii.
Najpravdepodobnejšie vdýchnutím infekčného aerosólu alebo prachu (pacientka bývala v blízkosti farmy), menej pravdepodobne kontaminovaným mliekom, mliečnymi výrobkami, alebo nedostatočne tepelne upraveným mäsom infikovaných zvierat, alebo po prisatí infikovaného kliešťa.
Áno - vrodenú srdcovú chybu a jej operačnú korekciu v detstve.
V prípade chronickej Q-horúčky, prejavujúcej sa subakútnou endokarditídou je liekom voľby kombinácia tetracyklínu s hydroxychlorochínom. Úspešný výsledok vyžaduje liečbu v trvaní minimálne 18 mesiacov. Konečná dĺžka antibiotickej liečby sa riadi výsledkami monitorovania titra protilátok proti fáze 1 C. burnetii. Napriek liečbe hrozí v niektorých prípadoch riziko relapsov.
Autor: Blažeková M.
Pracovisko: Mikrobiologický ústav LF UK a UNB
Kazuistika
61-ročný pacient bol prijatý do nemocnice pre neúspešnosť domácej liečby infekcie horných dýchacích ciest s nevýrazným klinickým obrazom. Bola prítomná dýchavičnosť, pocit slabosti, zvýšená teplota, nechutenstvo. Objektívne sa zistilo vezikulárne dýchanie a na RTG hrudníka obraz pleuropneumónie. Laboratórne parametre boli v norme. Začala sa antibiotická liečba cefalosporínom tretej generácie. Nastal ústup ťažkostí a napriek pretrvávaniu nálezu na RTG snímke bol pacient na vlastnú žiadosť prepustený do domáceho ošetrovania. Pacient bol po čase opakovane hospitalizovaný pre zhoršenie zdravotného stavu a stále pretrvávajúci pozitívny nález na pľúcach. Vyšetrenie protilátok proti C. pneumoniae bolo pozitívne v triede IgM aj IgG. Pacientovi sa nasadila liečba fluorochinolónmi a na jedenásty deň došlo k čiastočnej regresii nehomogénneho zatienenia v dolnom a strednom pľúcnom laloku. O ďalší týždeň, po podaní azitromycínu, došlo k podstatnej regresii tohto nálezu.
Otázky ku kazuistike:
1. Aké antibiotiká sú vhodné pre liečbu chlamýdiových infekcií?
2. Ktoré druhy chlamýdií môžu spôsobiť pneumóniu u ľudí?
3. Aké metódy sa používajú pri diagnostike chlamýdiovej pneumónie?
Vzhľadom na stavbu bunkovej steny, ktorá neobsahuje peptidoglykán, na liečbu používame antibiotiká ovplyvňujúce syntézu proteínov – makrolidy, tetracyklíny, fluorované chinolóny, prípadne klindamycín a rifampicín.
C. pneumoniae spôsobuje najčastejšie komunitné pneumónie vo všetkých vekových kategóriách, C. trachomatis môže byť pôvodcom pneumónii u novorodencov a C. psittaci je pôvodca atypickej pneumónie získanej od vtákov.
Na diagnostiku chlamýdiovej pneumónie môžeme použiť priame a nepriame metódy. Z priamych metód je to detekcia antigénu z nazofaryngeálneho výteru alebo bronchoalveolárnej laváže metódou ELISA alebo mikroimunofluorescenciou, možný je aj dôkaz DNA metódou PCR. Najpoužívanejšia je nepriama diagnostika – dôkaz protilátok typu IgM, IgA, IgG v sére pacienta. Vzhľadom na dlhodobé pretrvávanie protilátok v sére, dôležité je vyhodnotiť párovú vzorku, kde sledujeme dynamiku tvorby alebo odbúrania protilátok a tiež výsledky treba dať do súvisu s klinickými prejavmi ochorenia u pacienta.
© Liptáková Adriána a kolektív, 2019 – 2023
